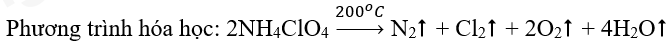Giải Hóa 10 Bài 12 trang 72, 73, 74, 75, 76, 77, 78, 79 Chân trời sáng tạo
Mời các em theo dõi nội dung bài học hôm nay Giải hóa 10 bài 12 trang 72, 73, 74, 75, 76, 77, 78, 79 Chân trời sáng tạo
Đom đóm có thể phát ra ánh sáng đặc biệt, không tỏa nhiệt như ánh sáng nhân tạo
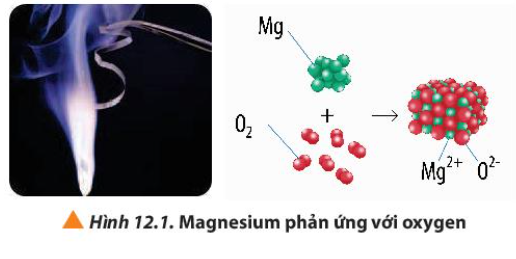
1. Quan sát Hình 12.1, hãy viết quá trình nhường và nhận electron trong phản ứng giữa magnesium và oxygen
Bạn đang xem: Giải Hóa 10 Bài 12 trang 72, 73, 74, 75, 76, 77, 78, 79 Chân trời sáng tạo
CH tr 72 MĐ
|
Đom đóm có thể phát ra ánh sáng đặc biệt, không tỏa nhiệt như ánh sáng nhân tạo. Cấu tạo bên trong lớp da bụng của đom đóm là dãy các tế bào phát quang có chứa luciferin. Luciferin tác dụng với oxygen, cùng xúc tác enzyme, để tạo ra ánh sáng. Đây là phản ứng oxi hóa – khử. Trong cuộc sống cũng như trong tự nhiên có nhiều hiện tượng mà nguyên nhân chính là do phản ứng oxi hóa – khử gây ra. Phản ứng oxi hóa – khử là gì? Vai trò quan trọng của chúng trong cuộc sống như thế nào? |
Lời giải:
– Phản ứng oxi hóa – khử là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phản ứng. Trong phản ứng oxi hóa – khử luôn xảy ra đồng thời quá trình oxi hóa và quá trình khử
– Vai trò của phản ứng oxi hóa – khử trong đời sống
+ Là cơ sở của quá trình sản xuất trong các ngành công nghiệp nặng, sản xuất hóa chất cơ bản
+ Sản xuất phân bón
+ Sản xuất thuốc bảo vệ thực vật
+ Sản xuất dược phẩm
CH tr 72 CH
|
1. Quan sát Hình 12.1, hãy viết quá trình nhường và nhận electron trong phản ứng giữa magnesium và oxygen |
Hướng dẫn giải:
– O tham gia quá trình nhận electron
– Mg tham gia quá trình nhường electron
Lời giải:
– O tham gia quá trình nhận electron
O + 2e → O2-
– Mg tham gia quá trình nhường electron
Mg → Mg2+ + 2e
CH tr 73 CH
|
2. Quan sát Hình 12.2a, hydrogen cháy trong chlorine với ngọn lửa sáng, tạo hợp chất hydrogen chlorine (HCl). Nếu cặp electron chung trong hợp chất cộng hóa trị HCl lệch hẳn về phía nguyên tử Cl (Hình 12.2b), hãy xác định điện tích của các nguyên tử trong phân tử HCl |
Hướng dẫn giải:
Trong phân tử HCl, mỗi nguyên tố bỏ ra 1 electron để góp chung tạo thành 1 cặp electron dùng chung
Lời giải:
– Trong phân tử HCl, mỗi nguyên tử bỏ ra 1 electron để góp chung tạo thành 1 cặp electron dùng chung
– Khi 1 cặp electron lệch hẳn về Cl
=> Có thể coi Cl nhận 1 electron và H nhường 1 electron
=> Cl sẽ mang điện tích -1 và H mang điện tích +1
CH tr 73 CH
|
3. Nêu điểm khác nhau giữa kí hiệu số oxi hóa và kí hiệu điện tích của ion M trong hình sau: |
Hướng dẫn giải:
Quan sát hình vẽ và rút ra nhận xét
Lời giải:
– Kí hiệu số oxi hóa: Dấu rồi đến số (+n)
Ví dụ: +1, +2, -1, -2
– Kí hiệu điện tích ion: Số rồi đến dấu (n-). Với điện tích có giá trị là 1 thì không cần ghi số 1
Ví dụ: Cl–, O2-, Na+, Ca2+.
CH tr 73 CH
|
4. Dự đoán số oxi hóa của các nguyên tử trong nhóm IA, IIA, IIIA trong các hợp chất. Giải thích |
Hướng dẫn giải:
Quy tắc 4: Kim loại kiềm (nhóm IA) luôn có số oxi hóa +1, kim loại kiềm thổ (nhóm IIA) có số oxi hóa +2. Nhôm (aluminium) có số oxi hóa +3
Lời giải:
– Nguyên tử nhóm IA có 1 electron ở lớp ngoài cùng, có xu hướng nhường 1 electron để đạt cấu hình electron bền vững của khí hiếm => Sẽ có số oxi hóa là +1
– Nguyên tử nhóm IIA có 2 electron ở lớp ngoài cùng, có xu hướng nhường 2 electron để đạt cấu hình electron bền vững của khí hiếm => Sẽ có số oxi hóa là +2
– Nguyên tử nhóm IIIA có 3 electron ở lớp ngoài cùng, có xu hướng nhường 3 electron để đạt cấu hình electron bền vững của khí hiếm => Sẽ có số oxi hóa là +3
CH tr 73 LT
|
Hãy xác định số oxi hóa của các nguyên tử trong các đơn chất, hợp chất và ion sau: Zn, H2, Cl–, O2-, S2-, HSO4–, Na2S2O3, KNO3 |
Hướng dẫn giải:
– Quy tắc 1: Số oxi hóa của nguyên tử trong các đơn chất = 0
– Quy tắc 2: Trong 1 phân tử, tổng số oxi góa của các nguyên tử = 0
– Quy tắc 3: Trong các ion, số oxi hóa của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hóa các nguyên tử (đối với ion đa nguyên tử) = điện tích của ion đó
– Quy tắc 4: Trong hợp chất, H chủ yếu +1, O là -2, nhóm IA là +1, nhóm IIA là +2, Al là +3
Lời giải:
– Zn là đơn chất => Số oxi hóa của nguyên tử Zn là 0
– H2 là đơn chất => Số oxi hóa của nguyên tử H trong H2 là 0
– Cl– là ion đơn nguyên tử có điện tích là 1- => Số oxi hóa của ion Cltrong Cl– là -1
– O2- là ion đơn nguyên tử có điện tích là 2- => Số oxi hóa của ion Otrong O2- là -2
– S2- là ion đơn nguyên tử có điện tích là 2- => Số oxi hóa của ion Strong S2- là -2
– HSO4–: gọi số oxi hóa của S trong ion là x.
Ta có: (+1).1 + x.1 + (-2).4 = -1
=> x = +6
Vậy số oxi hóa của H = +1, O = -2 và S = +6
– Na2S2O3: gọi số oxi hóa của S trong phân tử là x
Ta có: (+1).2 + x.2 + (-2).3 = 0
=> x = +2
Vậy số oxi hóa của Na = +1, S = +2, O = -2
– KNO3: gọi số oxi hóa của N trong phân tử là x
Ta có: (+1).1 + x.1 + (-2).3 = 0
=> x = +5
Vậy số oxi hóa của K = +1, N = +5, O = -2
CH tr 74 LT
|
Magnetite là khoáng vật sắt từ có hàm lượng sắt cao nhất được dùng trong ngành luyện gang, thép, với công thức hóa học là Fe3O4 Hãy xác định số oxi hóa của nguyên tử Fe trong hợp chất trên |
Hướng dẫn giải:
– Trong phân tử, tổng số oxi hóa của các nguyên tử = 0
– O trong hợp chất có số oxi hóa là -2
Lời giải:
– Gọi số oxi hóa của Fe trong hợp chất trên là x
Ta có: x.3 + (-2).4 = 0
=> x = +8/3
Vậy số oxi hóa của Fe trong Fe3O4 = +8/3
Hướng dẫn giải:
– Trong phân tử, tổng số oxi hóa của các nguyên tử = 0
– O trong hợp chất có số oxi hóa là -2
Lời giải:
– Gọi số oxi hóa của Fe trong hợp chất trên là x
Ta có: x.3 + (-2).4 = 0
=> x = +8/3
Vậy số oxi hóa của Fe trong Fe3O4 = +8/3
CH tr 75 CH
|
5. Hãy nhận xét và giải thích sự thay đổi số oxi hóa của các nguyên tử trong chất oxi hóa và chất khử trước và sau phản ứng |
Hướng dẫn giải:
– Chất khử là chất nhường electron để tạo thành ion mang điện tích dương
– Chất oxi hóa là chất nhận electron để tạo thành ion mang điện tích âm
Lời giải:
– Chất oxi hóa là chất nhận electron => Sau phản ứng, chất oxi hóa có số oxi hóa giảm so với trước phản ứng
– Chất khử là chất nhường electron => Sau phản ứng, chất khử có số oxi hóa tăng so với trước phản ứng
CH tr 75 LT
|
Cho phương trình hóa học của các phản ứng sau: H2S + Br2 → 2HBr + S↓ (1) 2KClO3 2KCl + 3O2↑ (2) CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O (3) Phản ứng nào là phản ứng oxi hóa – khử? Vì sao? Hãy xác định quá trình oxi hóa và quá trình khử của các phản ứng đó |
Hướng dẫn giải:
– Phản ứng oxi hóa – khử là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử
– Quá trình oxi hóa là quá trình nhường electron
– Quá trình khử là quá trình nhận electron
Lời giải:
– Xét phản ứng (1):
\({H_2}\mathop S\limits^{ – 2} + {\mathop {Br}\limits^0 _2} \to H\mathop {Br}\limits^{ – 1} + \mathop S\limits^0 \downarrow \)
+ Là phản ứng oxi hóa – khử vì nguyên tử S và Br có sự thay đổi số oxi hóa
+ Quá trình oxi hóa: S-2 → S0 + 2e
+ Quá trình khử: Br20 + 2e → Br-1
– Xét phản ứng (2): 
+ Là phản ứng oxi hóa – khử vì nguyên tử Cl và O có sự thay đổi số oxi hóa
+ Quá trình oxi hóa: 2O-2 → O20 + 4e
+ Quá trình khử: Cl+5 + 6e → Cl-1
– Xét phản ứng (3): CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
+ Không phải phản ứng oxi hóa – khử vì các nguyên tử không có sự thay đổi số oxi hóa
CH tr 76 CH
|
6. Làm thế nào để biết một phản ứng là phản ứng oxi hóa – khử? |
Hướng dẫn giải:
Xác định số oxi hóa của các nguyên tố trước và sau phản ứng
Lời giải:
– Để nhận biết một phản ứng oxi hóa – khử, cần xác định số oxi hóa của các nguyên tố trước và sau phản ứng
– Phản ứng nào có các nguyên tố thay đổi số oxi hóa => Phản ứng oxi hóa – khử
CH tr 76 LT
|
Hãy nêu 3 ví dụ về phản ứng có sự thay đổi số oxi hóa của nguyên tử và 3 ví dụ về phản ứng không có sự thay đổi số oxi hóa của nguyên tử |
Hướng dẫn giải:
– Phản ứng có sự thay đổi số oxi hóa của nguyên tử là phản ứng oxi hóa khử
Lời giải:
– 3 ví dụ về phản ứng có sự thay đổi số oxi hóa của nguyên tử là:
\({H_2}\mathop S\limits^{ – 2} + {\mathop {Br}\limits^0 _2} \to 2H\mathop {Br}\limits^{ – 1} + \mathop S\limits^0 \downarrow \)
\(2K\mathop {Mn}\limits^{ + 7} {O_4} + 16H\mathop {Cl}\limits^{ – 1} \to 2KCl + \mathop {2Mn}\limits^{ + 2} C{l_2} + {\mathop {5Cl}\limits^0 _2} \uparrow + {8H_2}O\)
\(2\mathop N\limits^{ – 3} {H_3} + {\mathop {3Br}\limits^0 _2} \to {2\mathop N\limits^0 _2} + 6H\mathop {Br}\limits^{ – 1} \)
– 3 ví dụ về phản ứng không có sự thay đổi số oxi hóa của nguyên tử là:
CaO + 2HCl → CaCl2 + H2O
MgSO4 + BaCl2 → BaSO4 + MgCl2
2HNO3 + Cu(OH)2 → Cu(NO3)2 + H2O
CH tr 77 LT
|
Lập phương trình hóa học của các phản ứng oxi hóa – khử sau, xác định vai trò của các chất tham gia phản ứng. \(KMn{O_4} + HCl \to KCl + MnC{l_2} + C{l_2} \uparrow + {H_2}O(1)\) \(N{H_3} + B{r_2} \to {N_2} + HBr(2)\) \(N{H_3} + CuO\xrightarrow{{{t^o}}}Cu + {N_2} + {H_2}O(3)\) \(Fe{S_2} + {O_2}\xrightarrow{{{t^o}}}F{e_2}{O_3} + S{O_2}(4)\) \(KCl{O_3}\xrightarrow{{{t^o},Mn{O_2}}}KCl + {O_2} \uparrow \)(5) |
Hướng dẫn giải:
– Nguyên tắc: Tổng số electron chất khử nhường = Tổng số electron chất oxi hóa nhận
Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử
Bước 2: Viết quá trình oxi hóa và quá trình khử
Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khửu nhường = tổng số electron chất oxi hóa nhận
Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại
Lời giải:
\(KMn{O_4} + HCl \to KCl + MnC{l_2} + C{l_2} \uparrow + {H_2}O(1)\)
Bước 1: \(K\mathop {Mn}\limits^{ + 7} {O_4} + H\mathop {Cl}\limits^{ – 1} \to KCl + \mathop {Mn}\limits^{ + 2} C{l_2} + {\mathop {Cl}\limits^0 _2} \uparrow + {H_2}O\)
Bước 2:
Quá trình oxi hóa: 2Cl-1 → Cl20 + 2e
Quá trình khử: Mn+7 + 5e → Mn+2
– KMnO4 là chất oxi hóa vì Mn trong KMnO4 nhận electron
– HCl là chất khử vì Cl trong HCl nhường electron
Bước 3: Xác định hệ số
|
5 x |
2Cl-1 → Cl20 + 2e |
|
2 x |
Mn+7 + 5e → Mn+2 |
Bước 4: Đặt hệ số
\(2KMn{O_4} + 16HCl \to 2KCl + 2MnC{l_2} + 5C{l_2} \uparrow + 8{H_2}O\)
\(N{H_3} + B{r_2} \to {N_2} + HBr(2)\)
Bước 1: \(\mathop N\limits^{ – 3} {H_3} + {\mathop {Br}\limits^0 _2} \to {\mathop N\limits^0 _2} + H\mathop {Br}\limits^{ – 1} \)
Bước 2:
Quá trình oxi hóa: 2N-3 → N20 + 6e
Quá trình khử: Br20 + 2e → 2Br–
– Br2 là chất oxi hóa vì Br nhận electron
– NH3 là chất khử vì N trong NH3 nhường electron
Bước 3: Xác định hệ số
|
1 x |
2N-3 → N20 + 6e |
|
3 x |
Br20 + 2e → 2Br– |
Bước 4: Đặt hệ số
\(2N{H_3} + 3B{r_2} \to {N_2} + 6HBr\)
\(N{H_3} + CuO\xrightarrow{{{t^o}}}Cu + {N_2} + {H_2}O(3)\)
Bước 1: \(\mathop N\limits^{ – 3} {H_3} + \mathop {Cu}\limits^{ + 2} O\xrightarrow{{{t^o}}}\mathop {Cu}\limits^0 + {\mathop N\limits^0 _2} + {H_2}O\)
Bước 2:
Quá trình oxi hóa: 2N-3 → N20 + 6e
Quá trình khử: Cu+2 + 2e → Cu0
– CuO là chất oxi hóa vì Cu trong CuO nhận electron
– NH3 là chất khử vì N trong NH3 nhường electron
Bước 3: Xác định hệ số
|
1 x |
2N-3 → N20 + 6e |
|
3 x |
Cu+2 + 2e → Cu0 |
Bước 4: Đặt hệ số
\(2N{H_3} + 3CuO\xrightarrow{{{t^o}}}3Cu + {N_2} + 3{H_2}O\)
\(Fe{S_2} + {O_2}\xrightarrow{{{t^o}}}F{e_2}{O_3} + S{O_2}(4)\)
Bước 1: Coi số oxi hóa của Fe và S trong FeS2 đều = 0
\(FeS_2^0 + {\mathop O\limits^0 _2}\xrightarrow{{{t^o}}}\mathop {F{e_2}}\limits^{ + 3} \mathop {{O_3}}\limits^{ – 2} + \mathop S\limits^{ + 4} \mathop {{O_2}}\limits^{ – 2} \)
Bước 2:
Quá trình oxi hóa: FeS20 → Fe+3 + 2S+6 + 15e
Quá trình khử: O20 + 4e → 2O-2
– O2 là chất oxi hóa vì O nhận electron
– FeS2 là chất khử vì FeS2 nhường electron
Bước 3: Xác định hệ số
|
4 x |
FeS20 → Fe+3 + 2S+6 + 15e |
|
15 x |
O20 + 4e → 2O-2 |
Bước 4: Đặt hệ số
\(4Fe{S_2} + 11{O_2}\xrightarrow{{{t^o}}}2F{e_2}{O_3} + 8S{O_2}\)
\(KCl{O_3}\xrightarrow{{{t^o},Mn{O_2}}}KCl + {O_2} \uparrow \)(5)
Bước 1: \(K\mathop {Cl}\limits^{ + 5} {\mathop O\limits^{ – 2} _3}\xrightarrow{{{t^o},Mn{O_2}}}K\mathop {Cl}\limits^{ – 1} + {\mathop O\limits^0 _2} \uparrow \)
Bước 2:
Quá trình oxi hóa: 2O-2 → O20 + 4e
Quá trình khử: Cl+5 + 6e → Cl-1
– KClO3 vừa là chất khử vừa là chất oxi hóa vì Cl trong KClO3 nhận electron, O trong KClO3 nhường electron
Bước 3: Xác định hệ số
|
3 x |
2O-2 → O20 + 4e |
|
2 x |
Cl+5 + 6e → Cl-1 |
Bước 4: Đặt hệ số
\(2KCl{O_3}\xrightarrow{{{t^o},Mn{O_2}}}2KCl + 3{O_2} \uparrow \)
CH tr 77 CH
|
7. Lập phương trình hóa học của phản ứng đốt cháy gas trong không khí và phản ứng kích nổ hỗn hợp nhiên liệu của tàu con thoi. Xác định vai trò của các chất trong mỗi phản ứng |
Hướng dẫn giải:
– Phản ứng đốt cháy gas: CH4 + O2 → CO2 + H2O
– Phản ứng kích nổ hỗn hợp nhiên liệu: H2 + O2 → H2O
Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử
Bước 2: Viết quá trình oxi hóa và quá trình khử
Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khửu nhường = tổng số electron chất oxi hóa nhận
Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại
Lời giải:
– Phản ứng đốt cháy gas: \(C{H_4} + {O_2}\xrightarrow{{{t^o}}}C{O_2} + {H_2}O\)
Bước 1: \(\mathop C\limits^{ – 4} {H_4} + {\mathop O\limits^0 _2}\xrightarrow{{{t^o}}}\mathop C\limits^{ + 4} {\mathop O\limits^{ – 2} _2} + {H_2}O\)
Bước 2:
Quá trình oxi hóa: C-4 → C+4 + 8e
Quá trình khử: O20 + 4e → 2O-2
– O2 là chất oxi hóa vì O nhận electron
– CH4 là chất khử vì C trong CH4 nhường electron
Bước 3: Xác định hệ số
|
1 x |
C-4 → C+4 + 8e |
|
2 x |
O20 + 4e → 2O-2 |
Bước 4: Đặt hệ số
\(C{H_4} + 2{O_2}\xrightarrow{{{t^o}}}C{O_2} + 2{H_2}O\)
– Phản ứng kích nổ hỗn hợp nhiên liệu: \({H_2} + {O_2}\xrightarrow{{{t^o}}}{H_2}O\)
Bước 1: \(\mathop {{H_2}}\limits^0 + \mathop {{O_2}}\limits^0 \xrightarrow{{{t^o}}}\mathop {{H_2}}\limits^{ + 1} \mathop O\limits^{ – 2} \)
Bước 2:
Quá trình oxi hóa: H20→ 2H+1 + 2e
Quá trình khử: O20 + 4e → 2O-2
– O2 là chất oxi hóa vì O nhận electron
– H2 là chất khử vì H nhường electron
Bước 3: Xác định hệ số
|
2 x |
H20→ 2H+1 + 2e |
|
1 x |
O20 + 4e → 2O-2 |
Bước 4: Đặt hệ số
\(2{H_2} + {O_2}\xrightarrow{{{t^o}}}2{H_2}O\)
CH tr 78 CH
|
8. Quan sát Hình 12.7 và độc thông tin, hãy lập phương trình hóa học của phản ứng quang hợp ở cây xanh. Quá trình quang hợp của thực vật có vai trò quan trọng như thế nào đối với cuộc sống? |
Hướng dẫn giải:
Phản ứng quang hợp:
\(C{O_2} + {H_2}O\xrightarrow{{a/s,dl}}{C_6}{H_{12}}{O_6} + {O_2}\)
Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử
Bước 2: Viết quá trình oxi hóa và quá trình khử
Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khửu nhường = tổng số electron chất oxi hóa nhận
Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại
Lời giải:
Bước 1: \(\mathop C\limits^{ + 4} {O_2} + {H_2}\mathop O\limits^{ – 2} \xrightarrow{{a/s,dl}}\mathop {{C_6}}\limits^0 {H_{12}}{O_6} + {\mathop O\limits^0 _2}\)
Bước 2:
Quá trình oxi hóa: 2O-2 → O20 + 4e
Quá trình khử: C+4 + 4e → C0
Bước 3: Xác định hệ số
|
1 x |
2O-2 → O20 + 4e |
|
1 x |
C+4 + 4e → C0 |
Bước 4: Đặt hệ số
\(6C{O_2} + 6{H_2}O\xrightarrow{{a/s,dl}}{C_6}{H_{12}}{O_6} + 6{O_2}\)
– Vai trò của quá trình quang hợp của thực vật có vai trò:
+ Cung cấp oxygen, giảm lượng khí thải carbonic
+ Tổng hợp chất hữu cơ, đưa năng lượng mặt trời vào hệ sinh thái
CH tr 78 CH
|
9. Từ thông tin về “Luyện kim”, viết phản ứng của khí carbon monoxide khử iron (III) oxide ở nhiệt độ cao. Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron, xác định vai trò của các chất trong phản ứng |
Hướng dẫn giải:
Phản ứng luyện kim:
\(CO + F{e_2}{O_3}\xrightarrow{{{t^o}}}Fe + C{O_2}\)
Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử
Bước 2: Viết quá trình oxi hóa và quá trình khử
Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khửu nhường = tổng số electron chất oxi hóa nhận
Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại
Lời giải:
Bước 1: \(\mathop C\limits^{ + 2} O + \mathop {F{e_2}}\limits^{ + 3} {O_3}\xrightarrow{{{t^o}}}\mathop {Fe}\limits^0 + \mathop C\limits^{ + 4} {O_2}\)
Bước 2:
Quá trình oxi hóa: C+2 → C+4 + 2e
Quá trình khử: Fe+3 + 3e → Fe0
Fe2O3 là chất oxi hóa vì Fe trong Fe2O3 nhận electron
CO là chất khử vì C trong CO nhường electron
Bước 3: Xác định hệ số
|
3 x |
C+2 → C+4 + 2e |
|
2 x |
Fe+3 + 3e → Fe0 |
Bước 4: Đặt hệ số
\(3CO + F{e_2}{O_3}\xrightarrow{{{t^o}}}2Fe + 3C{O_2}\)
CH tr 78 CH
|
10. Đọc thông tin về “Điện hóa” để biết được phản ứng oxi hóa – khử gắn liền với cuộc sống. Lập phương trình hóa học của phản ứng sinh ra dòng điện trong pin khi zinc phản ứng với manganese |
Hướng dẫn giải:
Phản ứng sinh ra dòng điện trong pin:
\(Zn + Mn{O_2}\xrightarrow{{kiem}}ZnO + M{n_2}{O_3}\)
Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử
Bước 2: Viết quá trình oxi hóa và quá trình khử
Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khửu nhường = tổng số electron chất oxi hóa nhận
Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại
Lời giải:
Bước 1: \(\mathop {Zn}\limits^0 + \mathop {Mn}\limits^{ + 4} {O_2}\xrightarrow{{kiem}}\mathop {Zn}\limits^{ + 2} O + \mathop {M{n_2}}\limits^{ + 3} {O_3}\)
Bước 2:
Quá trình oxi hóa: Zn0 → Zn+2 + 2e
Quá trình khử: Mn+4 + e → Mn+3
Bước 3: Xác định hệ số
|
1 x |
Zn0 → Zn+2 + 2e |
|
2 x |
Mn+4 + e → Mn+3 |
Bước 4: Đặt hệ số
\(Zn + 2Mn{O_2}\xrightarrow{{kiem}}ZnO + M{n_2}{O_3}\)
CH tr 78 VD
|
Hãy nêu thêm một số phản ứng oxi hóa – khử quan trọng gắn với đời sống hằng ngày |
Hướng dẫn giải:
– Phản ứng đốt cháy methane tạo ra năng lượng
– Phản ứng hô hấp hiếu khí
– Phản ứng hô hấp kị khí
Lời giải:
– Phản ứng đốt cháy methane tạo ra năng lượng:
CH4 + 2O2 \(\xrightarrow{{{t^o}}}\)CO2 + 2H2O + năng lượng
– Phản ứng hô hấp hiếu khí:
C6H12O6 + 6O2 → 6CO2 + 6H2O + 36 ATPs (năng lượng)
– Phản ứng hô hấp kị khí:
C6H12O6 → 2C2H5OH + 2CO2 + năng lượng
Bài tập 1
|
Bài 1: Tính số oxi hóa của nguyên tử có đánh dấu * trong các chất và ion dưới đây |
Hướng dẫn giải:
– Quy tắc 1: Số oxi hóa của nguyên tử trong các đơn chất = 0
– Quy tắc 2: Trong 1 phân tử, tổng số oxi góa của các nguyên tử = 0
– Quy tắc 3: Trong các ion, số oxi hóa của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hóa các nguyên tử (đối với ion đa nguyên tử) = điện tích của ion đó
– Quy tắc 4: Trong hợp chất, H chủ yếu +1, O là -2, nhóm IA là +1, nhóm IIA là +2, Al là +3
Lời giải:
a)
– K2Cr2O7: Gọi số oxi hóa của Cr trong K2Cr2O7 là x
=> (+1).2 + x.2 + (-2).7 = 0
=> x = +6
=> Số oxi hóa của Cr trong K2Cr2O7 là +6
– KMnO4: Gọi số oxi hóa của Mn trong KMnO4 là x
=> (+1).1 + x.1 + (-2).4 = 0
=> x = +7
=> Số oxi hóa của Mn trong KMnO4 là +7
– KClO4: Gọi số oxi hóa của Cl trong KClO4 là x
=> (+1).1 + x.1 + (-2).4 = 0
=> x = +7
=> Số oxi hóa của Cl trong KClO4 là +7
– NH4NO3: Gọi số oxi hóa của N cần tìm là x
=> x.1 + (+1).1 + (+5).1 + (-2).3 = 0
=> x = -3
=> Số oxi hóa của N cần tìm trong NH4NO3 là -3
b)
– AlO2–: Gọi số oxi hóa của Al trong AlO2– là x
=> x.1 + (-2).2 = -1
=> x = +3
=> Aố oxi hóa của Al trong AlO2– là +3
– PO43-: Gọi số oxi hóa của P trong PO43- là x
=> x.1 + (-2).4 = -3
=> x = +5
=> Số oxi hóa của P trong PO43- là +5
– ClO3–: Gọi số oxi hóa của Cl trong ClO3– là x
=> x.1 + (-2).3 = -1
=> x = +5
=> Số oxi hóa của Cl trong ClO3– là +5
– SO42-: Gọi số oxi hóa của S trong SO42- là x
=> x.1 + (-2).4 = -2
=> x = +6
=> Số oxi hóa của S trong SO42- là +6
Bài tập 2
|
Bài 2: Lập phương trình hóa học của các phản ứng sau bằng phương pháp thăng bằng electron, nêu rõ chất oxi hóa, chất khử trong mỗi trường hợp a) \(HCl + Mn{O_2}\xrightarrow{{{t^o}}}MnC{l_2} + C{l_2} \uparrow + {H_2}O\) b) \(KMn{O_4} + KN{O_2} + {H_2}S{O_4} \to MnS{O_4} + KN{O_3} + {K_2}S{O_4} + {H_2}O\) c) \(F{e_3}{O_4} + HN{O_3} \to Fe{(N{O_3})_3} + NO \uparrow + {H_2}O\) d) \({H_2}{C_2}{O_2} + KMn{O_4} + {H_2}S{O_4} \to C{O_2} \uparrow + MnS{O_4} + {K_2}S{O_4} + {H_2}O\) |
Hướng dẫn giải:
Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử
Bước 2: Viết quá trình oxi hóa và quá trình khử. Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron
Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khửu nhường = tổng số electron chất oxi hóa nhận
Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại
Lời giải:
a) \(HCl + Mn{O_2}\xrightarrow{{{t^o}}}MnC{l_2} + C{l_2} \uparrow + {H_2}O\)
Bước 1: \(H\mathop {Cl}\limits^{ – 1} + \mathop {Mn}\limits^{ + 4} {O_2}\xrightarrow{{{t^o}}}\mathop {Mn}\limits^{ + 2} C{l_2} + \mathop {C{l_2}}\limits^0 \uparrow + {H_2}O\)
Bước 2:
Quá trình oxi hóa: 2Cl-1 → Cl20 + 2e
Quá trình khử: Mn+4 + 2e → Mn+2
Chất oxi hóa là Mn trong MnO2 vì Mn nhận electron
Chất khử là Cl trong HCl vì Cl nhường electron
Bước 3: Xác định hệ số
|
1 x |
2Cl-1 → Cl20 + 2e |
|
1 x |
Mn+4 + 2e → Mn+2 |
Bước 4: Đặt hệ số
\(4HCl + Mn{O_2}\xrightarrow{{{t^o}}}MnC{l_2} + C{l_2} \uparrow + 2{H_2}O\)
b) \(KMn{O_4} + KN{O_2} + {H_2}S{O_4} \to MnS{O_4} + KN{O_3} + {K_2}S{O_4} + {H_2}O\)
Bước 1: \(K\mathop {Mn}\limits^{ + 7} {O_4} + K\mathop N\limits^{ + 3} {O_2} + {H_2}S{O_4} \to \mathop {Mn}\limits^{ + 2} S{O_4} + K\mathop N\limits^{ + 5} {O_3} + {K_2}S{O_4} + {H_2}O\)
Bước 2:
Quá trình oxi hóa: N+3 → N+5 + 2e
Quá trình khử: Mn+7 + 5e → Mn+2
Chất oxi hóa là Mn trong KMnO4 vì Mn nhận electron
Chất khử là N trong KNO2 vì N nhường electron
Bước 3: Xác định hệ số
|
5 x |
N+3 → N+5 + 2e |
|
2 x |
Mn+7 + 5e → Mn+2 |
Bước 4: Đặt hệ số
\(2KMn{O_4} + 5KN{O_2} + 3{H_2}S{O_4} \to 2MnS{O_4} + 5KN{O_3} + {K_2}S{O_4} + 3{H_2}O\)
c) \(F{e_3}{O_4} + HN{O_3} \to Fe{(N{O_3})_3} + NO \uparrow + {H_2}O\)
Bước 1: \(\mathop {F{e_3}}\limits^{ + 8/3} {O_4} + H\mathop N\limits^{ + 5} {O_3} \to \mathop {Fe}\limits^{ + 3} {(N{O_3})_3} + \mathop N\limits^{ + 2} O \uparrow + {H_2}O\)
Bước 2:
Quá trình oxi hóa: 3Fe+8/3 → 3Fe+3 + e
Quá trình khử: N+5 + 3e → N+2
Chất oxi hóa là N trong HNO3 vì N nhận electron
Chất khử là Fe trong Fe3O4 vì Fe nhường electron
Bước 3: Xác định hệ số
|
3 x |
3Fe+8/3 → 3Fe+3 + e |
|
1 x |
N+5 + 3e → N+2 |
Bước 4: Đặt hệ số
\(3F{e_3}{O_4} + 28HN{O_3} \to 9Fe{(N{O_3})_3} + NO \uparrow + 14{H_2}O\)
d) \({H_2}{C_2}{O_2} + KMn{O_4} + {H_2}S{O_4} \to C{O_2} \uparrow + MnS{O_4} + {K_2}S{O_4} + {H_2}O\)
Bước 1: \({H_2}\mathop {{C_2}}\limits^{ + 1} {O_2} + K\mathop {Mn}\limits^{ + 7} {O_4} + {H_2}S{O_4} \to \mathop C\limits^{ + 4} {O_2} \uparrow + \mathop {Mn}\limits^{ + 2} S{O_4} + {K_2}S{O_4} + {H_2}O\)
Bước 2:
Quá trình oxi hóa: 2C+1 → 2C+4 + 6e
Quá trình khử: Mn+7 + 5e → Mn+2
Chất oxi hóa là Mn trong KMnO4 vì Mn nhận electron
Chất khử là C trong C2H2O2 vì C nhường electron
Bước 3: Xác định hệ số
|
5 x |
2C+1 → 2C+4 + 6e |
|
6 x |
Mn+7 + 5e → Mn+2 |
Bước 4: Đặt hệ số
\(5{H_2}{C_2}{O_2} + 6KMn{O_4} + 9{H_2}S{O_4} \to 10C{O_2} \uparrow + 6MnS{O_4} + 3{K_2}S{O_4} + 14{H_2}O\)
Bài tập 3
|
Bài 3: Có nhiều hiện tượng xảy ra xung quanh ta, em hãy nêu hai phản ứng oxi hóa – khử gắn liền với cuộc sống hàng ngày và lập phương trình hóa học của các phản ứng đó bằng phương pháp thăng bằng electron. |
Hướng dẫn giải:
– Xác định những hiện tượng hóa học có xảy ra phản ứng oxi hóa – khử trong cuộc sống hàng ngày
– Viết và cân bằng các phương trình hóa học đó theo phương pháp thăng bằng electron
Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử
Bước 2: Viết quá trình oxi hóa và quá trình khử. Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron
Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khửu nhường = tổng số electron chất oxi hóa nhận
Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại
Lời giải:
– Hiện tượng gỉ sét: sắt thép để lâu ngày trong không khí thì trên bề mặt của chúng sẽ xuất hiện lớp màu nâu đỏ
Sơ đồ phản ứng: \(\mathop {Fe}\limits^0 + {\mathop O\limits^0 _2} \to {\mathop {Fe}\limits^{ + 8/3} _3}{\mathop O\limits^{ – 2} _4}\)
Quá trình oxi hóa: $\mathop {3Fe}\limits^0 \to 3\mathop {Fe}\limits^{ + 8/3} + 3.\frac{8}{3}e$
Quá trình khử: $\mathop {{O_2}}\limits^0 + 2.2e \to 2\mathop O\limits^{ – 2} $
|
1x |
$\mathop {3Fe}\limits^0 \to 3\mathop {Fe}\limits^{ + 8/3} + 3.\frac{8}{3}e$ |
|
2x |
$\mathop {{O_2}}\limits^0 + 2.2e \to 2\mathop O\limits^{ – 2} $ |
Phương trình hóa học: 3Fe + 2O2 → Fe3O4
– Hiện tượng sự cháy của cây nến: nến có thành phần chính là paraffin, khi cháy trong không khí sẽ sinh ra khí carbon dioxide và hơi nước
Sơ đồ phản ứng: C2H6 + O2 → CO2 + H2O\(\)
|
2x |
$2\mathop C\limits^{ – 3} \to 2\mathop C\limits^{ + 4} + 2.7e$ |
|
7x |
$\mathop {{O_2}}\limits^0 + 2.2e \to 2\mathop O\limits^{ – 2} $ |
Phương trình hóa học: 2C2H6 + 7O2 → 4CO2 + 6H2O
Bài tập 4
|
Bài 4: Viết phương trình hóa học của phản ứng điều chế muối zinc chloride (ZnCl2) bằng một phản ứng oxi hóa – khử và một phản ứng không phải là phản ứng oxi hóa – khử |
Hướng dẫn giải:
– Phản ứng oxi hóa khử là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất, phản ứng có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử
– Phản ứng không phải là phản ứng oxi hóa khử là các nguyên tử trong phân tử không thay đổi số oxi hóa
Lời giải:
– Phản ứng oxi hóa – khử: Zn + Cl2 → ZnCl2
+ Zn từ số oxi hóa 0 lên +2, Cl từ số oxi hóa 0 xuống -1
– Phản ứng không phải oxi hóa – khử: ZnO + 2HCl → ZnCl2 + H2O
Bài tập 5
|
Bài 5: Nhiên liệu rắn dành cho tên lửa tăng tốc của tàu vũ trụ con thoi là hỗn hợp gồm ammonium perchlorate (NH4ClO4) và bột nhôm. Khi được đốt đến trên 200oC, ammonium perchlorate nổ theo phản ứng sau: Lập phương trình hóa học của phản ứng bằng phương pháp thăng bằng electron. |
Hướng dẫn giải:
Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử
Bước 2: Viết quá trình oxi hóa và quá trình khử. Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron
Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khửu nhường = tổng số electron chất oxi hóa nhận
Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại
Lời giải:
Sơ đồ phản ứng: \(\mathop N\limits^{ – 3} {H_4}\mathop {Cl}\limits^{ + 7} {\mathop O\limits^{ – 2} _4}\xrightarrow{{{{200}^o}C}}{\mathop N\limits^0 _2} \uparrow + {\mathop {Cl}\limits^0 _2} \uparrow + {\mathop O\limits^0 _2} \uparrow + {H_2}O\)
Quá trình oxi hóa: $\mathop {2N}\limits^{ – 3} \to \mathop {{N_2}}\limits^0 + 2.3e$
$\mathop {4O}\limits^{ – 2} \to 2\mathop {{O_2}}\limits^0 + 4.2e$
Quá trình khử: $2\mathop {Cl}\limits^{ + 7} + 2.7e \to {\mathop {Cl}\limits^0 _2}$
|
1x |
$\mathop {2N}\limits^{ – 3} \to \mathop {{N_2}}\limits^0 + 2.3e$ $\mathop {4O}\limits^{ – 2} \to 2\mathop {{O_2}}\limits^0 + 4.2e$ ð Tổng: 14 e nhường |
|
1x |
$2\mathop {Cl}\limits^{ + 7} + 2.7e \to {\mathop {Cl}\limits^0 _2}$ |
Lý thuyết
>> Xem chi tiết: Lý thuyết bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Hy vọng với nội dung trong bài Giải hóa 10 bài 12 trang 72, 73, 74, 75, 76, 77, 78, 79 Chân trời sáng tạo
do thầy cô trường Trung học Bình Chánh biên soạn sẽ giúp các em nắm chắc kiến thức nội dung bài học tốt hơn để từ đó hoàn thành tất cả các bài tập trong SGK.
Đăng bởi: THCS Bình Chánh
Chuyên mục: Hóa học 10 Chân trời sáng tạo
- Giải Hóa 10 Bài 1 trang 6, 7, 8, 9, 10, 11, 12 Chân trời sáng tạo
- Giải Hóa 10 Bài 2 trang 13, 14, 15, 16, 17, 18, 19 Chân trời sáng tạo
- Giải Hóa 10 Bài 3 trang 20, 21, 22, 23, 24, 25 Chân trời sáng tạo
- Giải Hóa 10 Bài 4 trang 26, 27, 28, 29, 30, 31, 32, 33, 34 Chân trời sáng tạo
- Giải Hóa 10 Bài 5 trang 35, 36, 37, 38, 39, 40, 41, 42 Chân trời sáng tạo
- Giải Hóa 10 Bài 6 trang 43, 44, 45, 46, 47, 48 Chân trời sáng tạo