Giải Khoa học tự nhiên 7 Bài 7 Chân trời sáng tạo: Hóa trị và công thức hóa học | Giải KHTN 7
Mời các em theo dõi nội dung bài học do thầy cô trường Trung học Bình Chánh biên soạn sẽ giúp các em nắm chắc kiến thức nội dung bài học tốt hơn.
Giải bài tập Khoa học tự nhiên 7 Bài 7: Hóa trị và công thức hóa học
Bạn đang xem: Giải Khoa học tự nhiên 7 Bài 7 Chân trời sáng tạo: Hóa trị và công thức hóa học | Giải KHTN 7
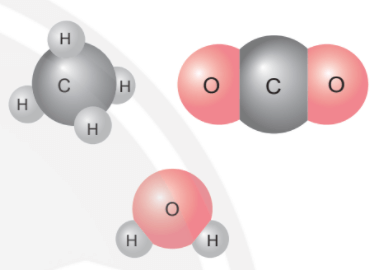
Mở đầu trang 45 Bài 7 KHTN lớp 7: Ở hình bên, ta thấy 1 nguyên tử carbon liên kết với 4 nguyên tử hydrogen hoặc chỉ liên kết với 2 nguyên tử oxygen; 1 nguyên tử oxygen liên kết được với 2 nguyên tử hydrogen; … Các nguyên tử liên kết với nhau theo nguyên tắc nào? Bằng cách nào để lập được công thức hóa học của các chất?
Trả lời:
– Các nguyên tử liên kết với nhau theo đúng hóa trị.
– Để lập được công thức hóa học của một chất cần biết được thành phần nguyên tố và số lượng nguyên tử của mỗi nguyên tố đó trong hợp chất hoặc biết được thành phần nguyên tố và hóa trị của các nguyên tố đó trong hợp chất.
1. Hóa trị
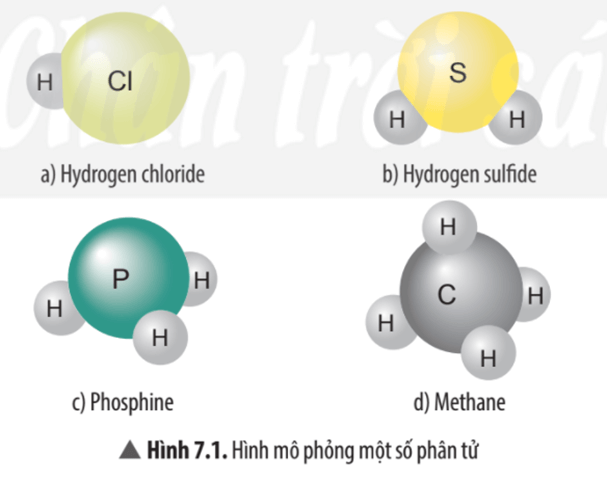
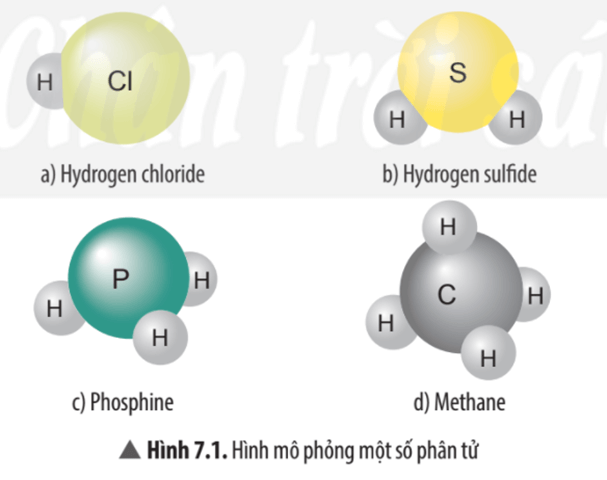
Câu hỏi thảo luận 1 trang 45 KHTN lớp 7: Hãy cho biết mỗi nguyên tử của nguyên tố Cl, S, P, C trong các phân tử ở Hình 7.1 có khả năng liên kết với bao nhiêu nguyên tử H?
Trả lời:
Hình 7.1 a) Nguyên tử Cl có khả năng liên kết với 1 nguyên tử H.
Hình 7.1 b) Nguyên tử S có khả năng liên kết với 2 nguyên tử H.
Hình 7.1 c) Nguyên tử P có khả năng liên kết với 3 nguyên tử H.
Hình 7.1 d) Nguyên tử C có khả năng liên kết với 4 nguyên tử H.
Câu hỏi thảo luận 2 trang 46 KHTN lớp 7: Xác định hóa trị của các nguyên tố Cl, S, P trong các phân tử ở Hình 7.1.
Trả lời:
– Trong phân tử hydrogen chloride nguyên tử Cl liên kết với 1 nguyên tử H vậy hóa trị của nguyên tử Cl bằng I.
– Trong phân tử hydrogen sulfide nguyên tử S liên kết với 2 nguyên tử H vậy hóa trị của nguyên tử S bằng II.
– Trong phân tử phosphine nguyên tử P liên kết với 3 nguyên tử H vậy hóa trị của nguyên tử P bằng III.
Vận dụng trang 46 KHTN lớp 7: Trong tự nhiên, silicon oxide có trong cát, đất sét,… Em hãy xác định hóa trị của nguyên tố silicon trong silicon dioxide. Tìm hiểu qua sách báo và internet, cho biết các ứng dụng của hợp chất này.
Trả lời:
Trong hợp chất silicon dioxide một nguyên tử Si có khả năng liên kết với 2 nguyên tử O (mỗi nguyên tử O hóa trị II) nên Si có hóa trị IV.
Ứng dụng của silicon dioxide:
– Dùng để sản xuất xi măng, nguyên liệu trong xây dựng…
– Làm kính phẳng, sản phẩm thủy tinh, sợi thủy tinh…
– Sản xuất đồ gốm;
– Sản xuất thạch anh dùng trong xử lí nước sạch;
– Sản xuất sodium silicate, dùng trong điều chế chất nhuộm màu, xà phòng.
Luyện tập 1 trang 46 KHTN lớp 7: Trong một hợp chất cộng hóa trị, nguyên tố X có hóa trị IV. Theo em, 1 nguyên tử X có khả năng liên kết với bao nhiêu nguyên tử O hoặc bao nhiêu nguyên tử H?
Trả lời:
Theo cách xác định hóa trị của nguyên tố, 1 nguyên tử X có hóa trị IV có khả năng liên kết với 2 nguyên tử O (mỗi nguyên tử O có hóa trị II) hoặc 4 nguyên tử H (mỗi nguyên tử H có hóa trị I).
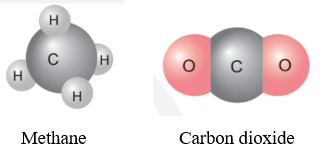
Ví dụ: Nguyên tố C hóa trị IV, có thể liên kết với 4 nguyên tử H để tạo thành phân tử methane và có thể liên kết với 2 nguyên tử O để tạo thành phân tử carbon dioxide.
2. Quy tắc hóa trị
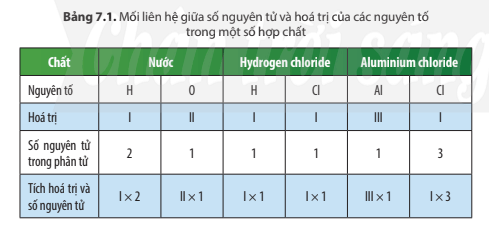
Câu hỏi thảo luận 3 trang 46 KHTN lớp 7: Em hãy so sánh về tích của hóa trị và số nguyên tử của hai nguyên tố trong phân tử mỗi hợp chất ở Bảng 7.1
Trả lời:
Dựa vào bảng 7.1, ta có:
Trong phân tử mỗi hợp chất, tích hóa trị và số nguyên tử của nguyên tố này bằng tích hóa trị và số nguyên tử của nguyên tố kia.
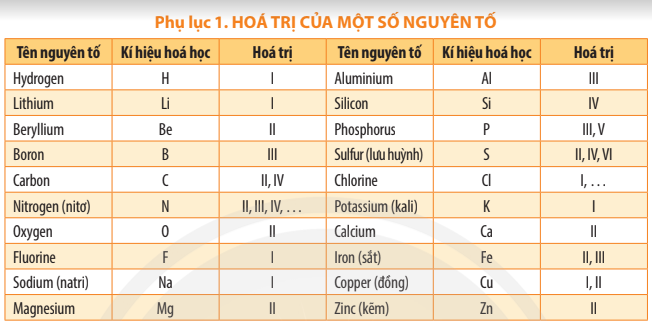
Luyện tập 2 trang 46 KHTN lớp 7: Dựa vào hóa trị các nguyên tố ở bảng Phụ lục 1 trang 187, em hãy cho biết một nguyên tử Ca có thể kết hợp với bao nhiêu nguyên tử Cl hoặc bao nhiêu nguyên tử O.
Trả lời:
Dựa theo bảng Phụ lục 1 trang 187, Ca có hóa trị II nên Ca có thể kết hợp với 2 nguyên tử Cl (hóa trị I) hoặc 1 nguyên tử O (hóa trị II).
3. Công thức hóa học
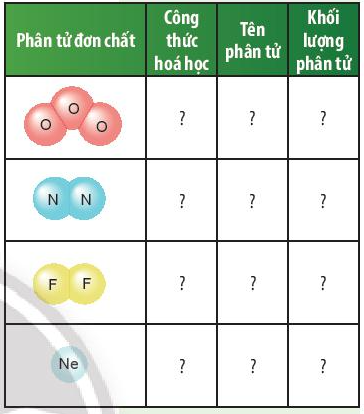
Câu hỏi thảo luận 4 trang 47 KHTN lớp 7: Dựa vào ví dụ 2, em hãy hoàn thành bảng sau:
Trả lời:
|
Công thức hóa học |
Tên phân tử |
Khối lượng phân tử |
|
|
|
O3 |
Ozone |
16 × 3 = 48 amu |
|
|
N2 |
Nitrogen |
14 × 2 = 28 amu |
|
|
F2 |
Fluorine |
19 × 2 = 38 amu |
|
|
Ne |
Neon |
20 amu |
Câu hỏi thảo luận 5 trang 47 KHTN lớp 7: Kể tên và viết công thức hóa học các đơn chất kim loại và đơn chất phi kim ở thể rắn.
Trả lời:
Đơn chất kim loại ở thể rắn: lithium (Li), sodium (Na), potassium (K), magnesium (Mg), aluminium (Al), iron (Fe), calcium (Ca), copper (Cu), gold (Au), silver (Ag), zinc (Zn),…
Đơn chất phi kim ở thể rắn: carbon (C), phosphorus (P), silicon (Si), sulfur (S), boron (B), iodine (I2),…
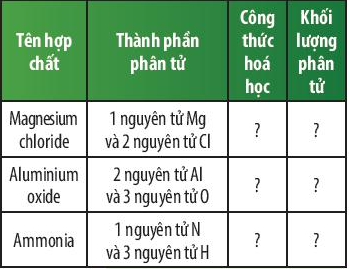
Câu hỏi thảo luận 6 trang 48 KHTN lớp 7: Em hãy hoàn thành bảng sau:
Trả lời:
|
Tên hợp chất |
Thành phần phân tử |
Công thức hóa học |
Khối lượng phân tử |
|
Magnesium chloride |
1 nguyên tử Mg và 2 nguyên tử Cl |
MgCl2 |
24 + 35,5 × 2 = 95 amu |
|
Aluminium oxide |
2 nguyên tử Al và 3 nguyên tử O |
Al2O3 |
27 × 2 + 16 × 3 = 102 amu |
|
Ammonia |
1 nguyên tử N và 3 nguyên tử H |
NH3 |
14 + 1 × 3 = 17 amu |
Câu hỏi thảo luận 7 trang 48 KHTN lớp 7: Công thức hóa học của iron(III) oxide là Fe2O3, hãy cho biết thành phần nguyên tố, số lượng nguyên tử của mỗi nguyên tố và tính khối lượng phân tử.
Trả lời:
– Iron(III) oxide được tạo thành từ 2 nguyên tố iron (Fe) và oxygen (O).
– Thành phần phân tử iron(III) oxide gồm 2 nguyên tử Fe và 3 nguyên tử O.
– Khối lượng phân tử bằng: 56 × 2 + 16 × 3 = 160 amu.
Câu hỏi thảo luận 8 trang 48 KHTN lớp 7: Công thức hóa học của một chất cho biết được những thông tin gì?
Trả lời:
Công thức hóa học cho biết: thành phần nguyên tố; tỉ lệ số nguyên tử của các nguyên tố; khối lượng phân tử của chất.
4. Tính phần trăm nguyên tố trong hợp chất
Câu hỏi thảo luận 9 trang 48 KHTN lớp 7 : Tính phần trăm mỗi nguyên tố có trong các hợp chất: Al2O3, MgCl2, Na2S, (NH4)2CO3
Trả lời:
– Hợp chất Al2O3 có:
%Al = = = 52,94%
%O = 100% – 52,94% = 47,06%
– Hợp chất MgCl2 có:
%Mg = = 25,26%
%Cl = 100% – 25,26% = 74,74%
– Hợp chất Na2S có:
%Na = = 58,97%
%S = 100% – 58,97% = 41,03%
– Hợp chất (NH4)2CO3 có:
%N = = 29,17%
%H = = 8,33%
%C = = 12,5%
%O = 100% – %N – %H – %C = 100% – 29,17% – 8,33% – 12,5% = 50%
Luyện tập 1 trang 49 KHTN lớp 7: Viết công thức hóa học của phosphoric acid có cấu tạo từ hydrogen và nhóm phosphate. Trong phosphoric acid, nguyên tố nào có phần trăm lớn nhất?
Trả lời:
Công thức hóa học của phosphoric acid là: H3PO4
%H = .100% = 3,06%
%P = .100% = 31,63%
%O = 100% – 3,06% – 31,63% = 65,31%
⇒ Trong phosphoric acid nguyên tố có phần trăm lớn nhất là oxygen.
5. Xác định công thức hóa học
Câu hỏi thảo luận 10 trang 49 KHTN lớp 7: Phân tử X có 75% khối lượng là aluminium, còn lại là carbon. Xác định công thức phân tử của X, biết khối lượng phân tử của nó là 144 amu.
Trả lời:
Đặt công thức cần tìm của X là AlxCy.
%C = 100% – %Al = 100% – 75% = 25%
%Al = = 75%
⇒ x = 4
%C = = 25%
⇒ y = 3
Vậy công thức hóa học của hợp chất X là Al4C3
Luyện tập 2 trang 49 KHTN lớp 7: Hợp chất (Y) có công thức FexOy, trong đó Fe chiếm 70% theo khối lượng. Khối lượng phân tử (Y) là 160 amu. Xác định công thức hóa học của hợp chất (Y)
Trả lời:
Với hợp chất FexOy ta có:
%O = 100% – %Fe = 100% – 70% = 30%
%Fe = = 70%
⇒ x = 2
%O = = 30%
⇒ y = 3
Vậy công thức hóa học của hợp chất Y là Fe2O3.
Vận dụng trang 50 KHTN lớp 7: Pháo hoa có thành phần nhiên liệu nổ gồm sulfur, than và hợp chất (Z). Hợp chất (Z) gồm nguyên tố potassium, nitrogen và oxygen với các tỉ lệ phần trăm tương ứng là 38,61%, 13,86% và 47,53%. Khối lượng phân tử của hợp chất (Z) là 101 amu. Xác định công thức hóa học của (Z).
Tìm hiểu qua sách, báo và internet, em hãy cho biết một số ứng dụng của hợp chất (Z).
Pháo hoa
Trả lời:
Đặt công thức hóa học của Z có dạng: KxNyOz. Trong Z có:
%K = = 38,61%
⇒ x = 1
%N = = 13,86%
⇒ y = 1
%O = = 47,535%
⇒ z = 3
Vậy công thức hóa học của hợp chất Z là KNO3.
Một số ứng dụng của KNO3:
– Chế tạo thuốc nổ.
– Trong nông nghiệp KNO3 được dùng để sản xuất phân bón (như phân kali, phân NPK …)
– Trong công nghiệp thực phẩm KNO3 được dùng làm chất phụ gia thực phẩm (E 252), KNO3 được xem là một trong những giải pháp tốt để bảo quản thịt chống ôi thiu, …
– Trong công nghiệp dược phẩm KNO3 được dùng để bào chế kem đánh răng dành cho răng nhạy cảm, thuốc làm giảm các triệu chứng hen suyễn và bệnh viêm khớp, …
KNO3
Câu hỏi thảo luận 11 trang 50 KHTN lớp 7: Dựa vào công thức (2), hãy tính hóa trị của nguyên tố
a) N trong phân tử NH3
b) S trong phân tử SO2, SO3
c) P trong phân tử P2O5
Trả lời:
a) Trong phân tử , ta có: a × 1 = I × 3 ⇒ a = III.
Vậy trong phân tử NH3 nguyên tố N có hóa trị III.
b) Trong phân tử , ta có: a × 1 = II × 2 ⇒ a = IV.
Vậy trong phân tử SO2 nguyên tố S có hóa trị IV.
Trong phân tử , ta có: a × 1 = II × 3 ⇒ a = VI.
Vậy trong phân tử SO3 nguyên tố S có hóa trị VI.
c) Trong phân tử , ta có: a × 2 = II × 5 ⇒ a = V
Vậy trong phân tử P2O5 nguyên tố P có hóa trị V.
Luyện tập trang 50 KHTN lớp 7: Dựa vào Ví dụ 8, 9 và các bảng hóa trị ở Phụ lục trang 187, hãy xác định công thức hóa học các hợp chất tạo bởi:
a) potassium và sulfate
b) aluminium và carbonate
c) magnesium và nitrate
Trả lời:
a) Công thức hóa học chung:
Theo quy tắc hóa trị ta có: x × I = y × II
Chuyển thành tỉ lệ:
Chọn x = 2; y = 1
Vậy công thức hóa học của hợp chất là K2SO4
b) Công thức hóa học chung:
Theo quy tắc hóa trị ta có: x × III = y × II
Chuyển thành tỉ lệ:
Chọn x = 2; y = 3
Vậy công thức hóa học của hợp chất là Al2(CO3)3
c) Công thức hóa học chung:
Theo quy tắc hóa trị ta có: x × II = y × I
Chuyển thành tỉ lệ:
Chọn x = 1; y = 2
Vậy công thức hóa học của hợp chất là Mg(NO3)2
Vận dụng trang 51 KHTN lớp 7: Bột thạch cao có nhiều ứng dụng quan trọng trong đời sống. Thành phần chính của bột thạch cao là hợp chất (M) gồm calcium và gốc sulfate. Xác định công thức hóa học của hợp chất (M).
Tìm hiểu thông qua sách, báo, internet và cho biết các ứng dụng của thạch cao.
Trả lời:
Xác định công thức hóa học của hợp chất M:
– Công thức hóa học chung của M:
– Theo quy tắc hóa trị ta có: x × II = y × II
– Chuyển thành tỉ lệ:
– Chọn x = 1; y = 1. Công thức hóa học của hợp chất M là CaSO4.
Một số ứng dụng của thạch cao:
– Trong xây dựng: làm vách ngăn, trang trí nội thất…
– Trong y tế: làm khung xương, bó bột …
– Trong mỹ thuật: đổ khuôn, đúc tượng …
Bài tập (trang 51)
Bài 1 trang 51 KHTN lớp 7: Viết công thức hóa học các hợp chất tạo bởi oxygen và mỗi nguyên tố sau: potassium, magnesium, aluminium, phosphorus (hóa trị V)
Trả lời:
– Hợp chất tạo bởi oxygen và potassium có dạng:
Theo quy tắc hóa trị ta có: x × I = y × II
Chuyển thành tỉ lệ:
Chọn x = 2; y = 1
Vậy công thức hóa học của hợp chất là K2O
– Hợp chất tạo bởi oxygen và magnesium có dạng:
Theo quy tắc hóa trị ta có: x × II = y × II
Chuyển thành tỉ lệ:
Chọn x = 1; y = 1
Vậy công thức hóa học của hợp chất là MgO
– Hợp chất tạo bởi oxygen và aluminium có dạng:
Theo quy tắc hóa trị ta có: x × III = y × II
Chuyển thành tỉ lệ:
Chọn x = 2; y = 3
Vậy công thức hóa học của hợp chất là Al2O3
– Hợp chất tạo bởi oxygen và phosphorus có dạng:
Theo quy tắc hóa trị ta có: x × V = y × II
Chuyển thành tỉ lệ:
Chọn x = 2; y = 5
Vậy công thức hóa học của hợp chất là P2O5
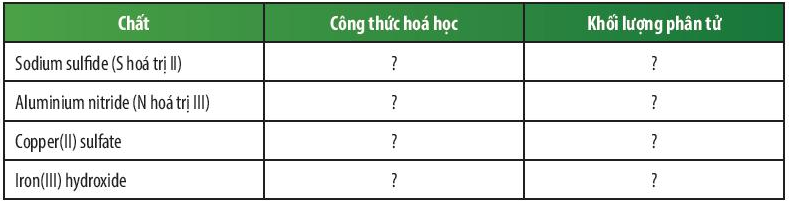
Bài 2 trang 51 KHTN lớp 7: Dựa vào bảng hóa trị ở Phụ lục trang 187, em hãy hoàn thành bảng sau:
Trả lời:
|
Chất |
Công thức hóa học |
Khối lượng phân tử |
|
Sodium sulfide (S hóa trị II) |
Na2S |
23 × 2 + 32 = 78 amu |
|
Aluminium nitride (N hóa trị III) |
AlN |
27 + 14 = 41 amu |
|
Copper(II) sulfate |
CuSO4 |
64 + 32 + 16 × 4 = 160 amu |
|
Iron(III) hydroxide |
Fe(OH)3 |
56 + 16 × 3 + 1 × 3 = 107 amu |
Bài 3 trang 51 KHTN lớp 7: Thạch nhũ trong hang động có thành phần chính là hợp chất (T). Phân tử (T) có cấu tạo từ nguyên tố calcium, carbon và oxygen với các tỉ lệ phần trăm tương ứng là 40%, 12% và 48%. Khối lượng phân tử (T) là 100 amu. Hãy xác định công thức hóa học của (T).
Trả lời:
Hợp chất T có công thức cần tìm là CaxCyOz.
%Ca = = 40%
⇒ x = 1
%C = = 12%
⇒ y = 1
%O = = 48%
⇒ z = 3
Vậy công thức hóa học của hợp chất là CaCO3
Xem thêm lời giải bài tập Khoa học tự nhiên lớp 7 Chân trời sáng tạo hay, chi tiết khác:
Bài 8: Tốc độ chuyển động
Bài 9: Đồ thị quãng đường – thời gian
Bài 10: Đo tốc độ
Bài 11: Tốc độ và an toàn giao thông
Bài 12: Mô tả sóng âm
Xem thêm tài liệu Khoa học tự nhiên lớp 7 Chân trời sáng tạo hay, chi tiết khác:
Lý thuyết Bài 7: Hóa trị và công thức hóa học
Trắc nghiệm Bài 7: Hóa trị và công thức hóa học
Đăng bởi: THCS Bình Chánh
Chuyên mục: Khoa học tự nhiên 7 Chân trời sáng tạo
- Giải Khoa học tự nhiên 7 Bài 1 Chân trời sáng tạo: Phương pháp và kĩ năng học tập môn Khoa học tự nhiên | Giải KHTN 7
- Giải Khoa học tự nhiên 7 Bài 2 Chân trời sáng tạo: Nguyên tử | Giải KHTN 7
- Giải Khoa học tự nhiên 7 Bài 3 Chân trời sáng tạo: Nguyên tố hóa học | Giải KHTN 7
- Giải Khoa học tự nhiên 7 Bài 4 Chân trời sáng tạo: Sơ lược bảng tuần hoàn các nguyên tố hóa học | Giải KHTN 7
- Giải Khoa học tự nhiên 7 Bài 5 Chân trời sáng tạo: Phân tử – Đơn chất – Hợp chất | Giải KHTN 7
- Giải Khoa học tự nhiên 7 Bài 6 Chân trời sáng tạo: Giới thiệu về liên kết hóa học | Giải KHTN 7