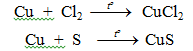Tính chất hóa học của Đồng
Mời các em theo dõi nội dung bài học Tính chất hóa học của Đồng do thầy cô trường THCS Bình Chánh biên soạn sẽ giúp các em nắm chắc kiến thức nội dung bài học tốt hơn.
Tính chất hóa học của Đồng
Tính chất hóa học của Đồng được THCS Bình Chánh sưu tầm và đăng tải, tổng hợp các câu hỏi lí thuyết trong chương trình giảng dạy môn Hóa học. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
I. Định nghĩa
– Đồng là nguyên tố hóa học trong bảng tuần hoàn nguyên tố có ký hiệu Cu và số nguyên tử bằng 29. Đồng là kim loại dẻo có độ dẫn điện và dẫn nhiệt cao. Nó được sử dụng làm chất dẫn nhiệt và điện, vật liệu xây dựng, và thành phần của các hợp kim của nhiều kim loại khác nhau.
Bạn đang xem: Tính chất hóa học của Đồng
– Kí hiệu: Cu
– Cấu hình electron: 1s22s22p63s23p63d104s1 hay [Ar]3d104s1.
– Số hiệu nguyên tử: 29
– Khối lượng nguyên tử: 64 g/mol
– Vị trí trong bảng tuần hoàn
+ Ô: số 29
+ Nhóm: IB
+ Chu kì: 4
– Đồng vị: 63Cu, 64Cu, 65Cu.
– Độ âm điện: 1,9
II. Tính chất vật lí & nhận biết
1. Tính chất vật lí:
– Là kim loại màu đỏ, dẻo, dễ kéo sợi và tráng mỏng.
– Dẫn điện và nhiệt rất cao (chỉ kém hơn bạc). D = 8,98g/cm3; t0nc= 1083oC
2. Nhận biết
– Đơn chất đồng có màu đỏ, các hợp chất của đồng ở trạng thái dung dịch có màu xanh đặc trưng.
– Hòa tan Cu vào dung dịch HNO3 loãng, thấy thu được dung dịch có màu xanh lam, thoát ra khí không màu hóa nâu trong không khí (NO).
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
III. Tính chất hóa học
– Là kim loại kém hoạt động, có tính khử yếu.
Tác dụng với phi kim:
– Cu phản ứng với oxi khi đun nóng tạo CuO bảo vệ nên Cu không bị oxi hoá tiếp tục.
– Khi tiếp tục đun nóng tới (800-1000oC)
– Tác dụng với Cl2, Br2, S…
Tác dụng với axit:
– Cu không tác dụng với dung dịch HCl, H2SO4 loãng.
– Khi có mặt oxi, Cu tác dụng với dung dịch HCl, nơi tiếp xúc giữa dung dịch axit với không khí.
2Cu + 4HCl + O2 → 2CuCl2 + 2 H2O
– Với HNO3, H2SO4 đặc:
Cu + 2H2SO4 đ → CuSO4 + SO2 + H2O
Cu + 4HNO3 đ → Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO + 4H2O
Tác dụng với dung dịch muối:
– Khử được ion kim loại đứng sau nó trong dung dịch muối.
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
IV. Trạng thái tự nhiên
– Hầu hết đồng được khai thác hoặc chiết tách ở dạng đồng sunfua từ các mỏ đồng. Khai thác lộ thiên chứa từ 0,4 đến 1,0% đồng.
V. Điều chế
– Xuất phát từ việc tinh chế quặng đồng
Ôxit đồng được chuyển thành đồng blister theo phản ứng nung:
2Cu2O → 4Cu + O2
VI. Ứng dụng
– Dựa vào tính dẻo, dẫn điện, dẫn nhiệt, bền của đồng và hợp kim:
- Đồng thau: hợp kim Cu-Zn, có tính cứng và bền hơn Cu, dùng chế tạo chi tiết máy.
- Đồng bạch: hợp kim Cu-Ni, có tính bền, đẹp, không bị ăn mòn trong nước biển, dùng trong công nghiệp tàu thủy.
- Đồng thanh: hợp kim Cu-Sn, dùng chế tạo máy móc, thiết bị.
- Hợp kim Cu-Au: dùng để trang trí.
VII. Các hợp chất quan trọng của Đồng
– Đồng (II) oxit: CuO
– Đồng(II) hiđroxit: Cu(OH)2
– Muối Cu(II): CuCl2, CuSO4, Cu(NO3)2…..
Tính chất hóa học của Đồng trên đây được THCS Bình Chánh sưu tầm và giới thiệu nhằm giúp các em học sinh hiểu rõ hơn về tính chất hóa học, vật lí, nhận biết, điều chế và ứng dụng của tất cả các đơn chất, hợp chất hóa học đã học trong chương trình Hóa học.
Đăng bởi: THCS Bình Chánh
Chuyên mục: Học Tập
- Cao Bá Quát là ai? Những chuyện ít người biết về Cao Bá Quát
- “Cười là một hình thức chế ngự cái xấu” (Phương Lựu – Trần Đình Sử – Lê Ngọc Trà, Lí luận văn học, tập 1, NXB Giáo dục, 1986, tr. 241). Viết đoạn văn (khoảng 7 – 9 câu) trình bày suy nghĩ của em về ý kiến trên lớp 8 (6 Mẫu)
- (NH4)2SO4 + BaCl2 → NH4Cl + BaSO4
- (NH4)2SO4 + NaOH → Na2SO4 + NH3 + H2O
- 1 đại đội có bao nhiêu người? Các đại đội của Quân đội Nhân dân Việt Nam
- 1 hình nền mở khóa điện thoại hài hước, dí dỏm nhất
- 1 Lunatic 1 Ice Pick là gì? Video gây án khiến cả thế giới phải rúng động
- 10 mẫu mở bài Từ ấy hay nhất