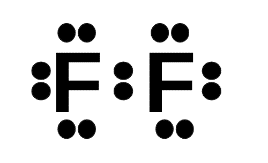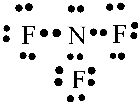Giải Hóa 10 Bài 10 trang 49, 50 Kết nối tri thức
Mời các em theo dõi nội dung bài học hôm nay Giải hóa 10 bài 10 trang 49, 50 Kết nối tri thức
Khi các nguyên tử kết hợp với nhau tạo thành phân tử theo một tỉ lệ xác định,
1. Khi nguyên tử fluorine nhận thêm 1 electron thì ion
2. Để giảm năng lượng, các nguyên tử kết hợp lại thành phân tử theo xu hướng nào?
Bạn đang xem: Giải Hóa 10 Bài 10 trang 49, 50 Kết nối tri thức
CH tr 49 MĐ
|
Khi các nguyên tử kết hợp với nhau tạo thành phân tử theo một tỉ lệ xác định, yếu tố nào quyết định tỉ lệ số nguyên tử của mỗi nguyên tố trong phân tử đó? |
Hướng dẫn giải:
Các nguyên tử khi liên kết với nhau có xu hướng đạt tới cấu hình electron bền vững của khí hiếm.
Lời giải:
Hầu hết nguyên tử các nguyên tố trong bảng tuần hoàn đều không đủ 8 electron lớp ngoài cùng nên có xu hướng đạt cấu hình electron bền vững bằng cách kết hợp với các nguyên tử khác theo tỉ lệ nhất định.
CH tr 49 CH
| Khi nguyên tử fluorine nhận thêm 1 electron thì ion tạo thành có cấu hình electron của nguyên tử nguyên tố nào? |
Hướng dẫn giải:
Cấu hình electron của F: 1s22s22p5
Cấu hình electron của F khi nhận thêm 1 electron: 1s22s22p6.
Lời giải:
Khi nguyên tử F nhận thêm 1 electron thì ion tạo thành có cấu hình electron của nguyên tử nguyên tố Ne.
CH tr 49 CH
| Để giảm năng lượng, các nguyên tử kết hợp lại thành phân tử theo xu hướng nào? |
Hướng dẫn giải:
Khi tạo liên kết hóa học thì nguyên tử có xu hướng đạt tới cấu hình electron bền vững.
Lời giải:
Để giảm năng lượng, các nguyên tử kết hợp lại thành phân tử theo xu hướng đạt tới cấu hình electron bền vững của khí hiếm.
CH tr 50 CH
| Vận dụng quy tắc octet để giải thích sự hình thành liên kết trong các phân tử: F2, CCl4, NF3. |
Hướng dẫn giải:
Sử dụng quy tắc octet: Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm.
Lời giải:
– Khi hình thành liên kết hóa học trong phân tử F2, nguyên tử fluorine có 7 electron hóa trị, mỗi nguyên tử fluorine cần thêm 1 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử fluorine góp chung một 1 electron. Phân tử F2 được biểu diễn
Xung quanh mỗi nguyên tử fluorine đều có 8 electron
– Khi hình thành liên kết hóa học trong phân tử CCl4, nguyên tử carbon có 4 electron hóa trị, nguyên tử carbon cần thêm 4 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử chlorine góp chung một 1 electron. Phân tử CCl4 được biểu diễn
Xung quanh mỗi nguyên tử carbon và chlorine đều có 8 electron
– Khi hình thành liên kết hóa học trong phân tử NF3, nguyên tử nitrogen có 5 electron hóa trị, nguyên tử nitrogen cần thêm 3 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử fluorine góp chung một 1 electron. Phân tử NF3 được biểu diễn
Xung quanh mỗi nguyên tử nitrogen và florine đều có 8 electron
CH tr 50 CH
|
Phosphine là hợp chất hóa học giữa phosphorus với hydrogen, có công thức hóa học là PH3. Đây là chất khí không màu, có mùi tỏi, rất độc, không bền. Phosphine sinh ra khi phân hủy xác động, thực vật và thường lẫn một lượng nhỏ diphosphine (P2H4) nên nó có thể tự cháy trong không khí ở điều kiện thường và tạo thành khối phát sáng bay lơ lửng (hiện tượng “ma trơi”). Vận dụng quy tắc octet để giải thích sự tạo thành liên kết hóa học trong phosphine. |
Hướng dẫn giải:
Sử dụng quy tắc octet: Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm.
Lời giải:
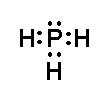
– Khi hình thành liên kết hóa học trong phân tử PH3, nguyên tử phosphorus có 5 electron hóa trị, nguyên tử phosphorus cần thêm 3 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử hydrogen góp chung một 1 electron. Phân tử PH3 được biểu diễn
Xung quanh mỗi nguyên tử phosphorus đều có 8 electron.
Lý thuyết
>> Xem chi tiết: Lý thuyết bài 10: Quy tắc octet
Hy vọng với nội dung trong bài Giải hóa 10 bài 10 trang 49, 50 Kết nối tri thức
do thầy cô trường Trung học Bình Chánh biên soạn sẽ giúp các em nắm chắc kiến thức nội dung bài học tốt hơn để từ đó hoàn thành tất cả các bài tập trong SGK.
Đăng bởi: THCS Bình Chánh
Chuyên mục: Hóa học 10 Kết nối tri thức
- Giải Hóa 10 Bài 1 trang 13, 14, 15, 16 Kết nối tri thức
- Giải Hóa 10 Bài 2 trang 17, 18, 19, 20 Kết nối tri thức
- Giải Hóa 10 Bài 3 trang 21, 22, 23, 24, 25 Kết nối tri thức
- Giải Hóa 10 Bài 4 trang 26, 27 Kết nối tri thức
- Giải Hóa 10 Bài 5 trang 30, 31, 32, 33 Kết nối tri thức
- Giải Hóa 10 Bài 6 trang 34, 35, 36, 37, 38, 39 Kết nối tri thức