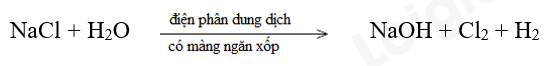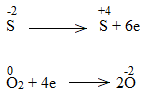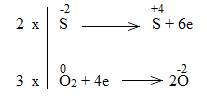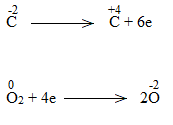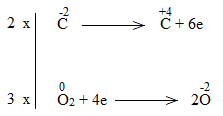Giải Hóa 10 Bài 16 trang 78, 79 Kết nối tri thức
Mời các em theo dõi nội dung bài học hôm nay Giải hóa 10 bài 16 trang 78, 79 Kết nối tri thức
Trong phản ứng oxi hóa – khử, chất oxi hóa là chất
A. nhận electron
B. nhường proton
C. nhường electron
D. nhận proton
Trong phản ứng hóa học: Fe + H2SO4 FeSO4 + H2, mỗi nguyên tử Fe đã
A. nhường 2 electron
B. nhận 2 electron
C. nhường 1 electron
D. nhận 1 electron
Bạn đang xem: Giải Hóa 10 Bài 16 trang 78, 79 Kết nối tri thức
Bài tập 1
|
Câu 1. Trong phản ứng oxi hóa – khử, chất oxi hóa là chất A. nhận electron B. nhường proton C. nhường electron D. nhận proton |
Hướng dẫn giải:
Chất oxi hóa là chất nhận electron
Lời giải:
Đáp án A
Bài tập 2
|
Câu 2. Trong phản ứng hóa học: Fe + H2SO4 → FeSO4 + H2, mỗi nguyên tử Fe đã A. nhường 2 electron B. nhận 2 electron C. nhường 1 electron D. nhận 1 electron |
Hướng dẫn giải:
Lời giải:
Trong phản ứng, Fe từ số oxi hóa 0 lên số oxi hóa +2
=> Mỗi nguyên tử Fe đã nhường 2 electron
=> Đáp án A
Bài tập 3
|
Câu 3. Trong phản ứng hóa học: 2Na + 2H2O → 2NaOH + H2, chất oxi hóa là A. H2O B. NaOH C. Na D. H2 |
Hướng dẫn giải:
Chất oxi hóa là chất nhận electron
Lời giải:
Trong phản ứng hóa học: 2Na + 2H2O → 2NaOH + H2, chất oxi hóa là H2O
=> Đáp án A
Bài tập 4
|
Câu 4. Cho nước Cl2 vào dung dịch NaBr xảy ra phản ứng hóa học: Cl2 + 2NaBr → 2NaCl + Br2 Trong phản ứng hóa học trên, xảy ra quá trình oxi hóa chất nào? A. NaCl. B. Br2. C. Cl2. D. NaBr. |
Hướng dẫn giải:
Quá trình oxi hóa là quá trình chất khử nhường electron.
Lời giải:
Trong phản ứng hóa học Cl2 + 2NaBr 2NaCl + Br2, xảy ra quá trình oxi hóa chất NaBr
=> Đáp án D
Bài tập 5
|
Câu 5. Xét các phản ứng hóa học xảy ra trong các quá trình sau: a) Luyện gang từ quặng hematit đó: Fe2O3 + CO \(\xrightarrow{{{t^o}}}\) FeO + CO2 FeO + CO \(\xrightarrow{{{t^o}}}\) Fe + CO2 b) Luyện kẽm từ quặng blend: ZnS + O2 \(\xrightarrow{{{t^o}}}\) ZnO + SO2 ZnO + C \(\xrightarrow{{{t^o}}}\) Zn + CO c) Sản xuất xút, chlorine từ dung dịch muối ăn: d) Đốt cháy ethanol có trong xăng E5: C2H5OH + O2 \(\xrightarrow{{{t^o}}}\) CO2 + H2O Hãy chỉ ra các phản ứng oxi hóa – khử, lập phương trình hóa học của các phản ứng đó theo phương pháp thăng bằng electron và chỉ rõ chất oxi hóa, chất khử. |
Hướng dẫn giải:
Dấu hiệu để nhận biết phản ứng oxi hóa – khử là có sự thay đổi số oxi hóa của các nguyên tử.
Lời giải:
Các phản ứng oxi hóa – khử là: a; b; c và d.
a)
* Fe2O3 + CO \(\xrightarrow{{{t^o}}}\) FeO + CO2
Bước 1:
Bước 2:
Bước 3:
Bước 4:
Fe2O3 + CO \(\xrightarrow{{{t^o}}}\) 2FeO + CO2
Fe2O3 là chất oxi hóa.
CO là chất khử.
* FeO + CO \(\xrightarrow{{{t^o}}}\) Fe + CO2
Bước 1:
Bước 2:
Bước 3:
Bước 4:
FeO + CO \(\xrightarrow{{{t^o}}}\) Fe + CO2
FeO là chất oxi hóa.
CO là chất khử.
b)
* ZnS + O2 \(\xrightarrow{{{t^o}}}\) ZnO + SO2
Bước 1:
Bước 2:
Bước 3:
Bước 4:
2ZnS + 3O2 \(\xrightarrow{{{t^o}}}\) 2ZnO + 2SO2
* ZnO + C \(\xrightarrow{{{t^o}}}\) Zn + CO
Bước 1:
Bước 2:
Bước 3:
Bước 4:
ZnO + C \(\xrightarrow{{{t^o}}}\) Zn + CO
ZnS là chất khử.
O2 là chất oxi hóa
c)

Bước 1:
Bước 2:
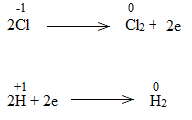
Bước 3:
Bước 4:

NaCl là chất khử.
H2O là chất oxi hóa.
d) C2H5OH + O2 \(\xrightarrow{{{t^o}}}\) CO2 + H2O
Bước 1:
Bước 2:
Bước 3:
Bước 4:
C2H5OH + 9/2O2 \(\xrightarrow{{{t^o}}}\) 2CO2 + 6H2O
C2H5OH là chất khử.
O2 là chất oxi hóa.
Bài tập 6
|
Câu 6. Xét phản ứng trong giai đoạn đầu của quá trình Ostwald: NH3 + O2 → NO + H2O Trong công nghiệp, cần trộn 1 thể tích khí ammonia với bao nhiêu thể tích không khí để thực hiện phản ứng trên? Biết không khí chứa 21% thể tích oxygen và các thể tích khi đo ở cùng điều kiện về nhiệt độ và áp suất. |
Hướng dẫn giải:
Sử dụng phương pháp thăng bằng electron để cân bằng phản ứng => Tỉ lệ phản ứng
4NH3 + 5O2 → 4NO + 6H2O
Lời giải:
4NH3 + 5O2 → 4NO + 6H2O
– Theo tỉ lệ phản ứng, cứ 4 thể tích khí ammonia phản ứng với 5 thể tích khí oxygen
=> 1 thể tích khí ammonia phản ứng với 1,25 thể tích khí oxygen
– Không khí chứa 21% thể tích khí oxygen
=> Thể tích không khí để thực hiện phản ứng với 1 thể tích khí ammonia là 5,95.
Bài tập 7
|
Câu 7. Copper (II) sulfate được dùng để diệt tảo, rong rêu trong nước bể bơi; dùng để pha chế thuốc Bordaux ( trừ bệnh mốc sương trên cây cà chua, khoai tây; bệnh thối thân trên cây ăn quả, cây công nghiệp)… Cu + O2 + H2SO4 → CuSO4 + H2O (1) a) Lập phương trình hóa học của phản ứng (1) theo phương pháp thăng bằng electron, chỉ rõ chất oxi hóa, chất khử. b) Copper (II) sulfate còn được điều chế bằng cách cho đồng phế liệu tác dụng với sulfuric acid đặc, nóng: Cu + H2SO4 (đặc) \(\xrightarrow{{{t^o}}}\) CuSO4 + SO2 + H2O (2) Trong hai cách trên, cách nào sử dụng ít sulfuric acid hơn, cách nào ít gây ô nhiễm môi trường hơn? |
Hướng dẫn giải:
– Chất nhường electron là chất khử
– Chất nhận electron là chất oxi hóa
– Các bước lập phương trình hóa học:
Bước 1: Xác định số oxi hóa của nguyên tử bị thay đổi:
Bước 2: Biểu diễn quá trình oxi hóa – khử:
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa theo nguyên tắc: tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
Lời giải:
a)
Bước 1: Xác định số oxi hóa của nguyên tử bị thay đổi:
Cu: chất khử
O2: chất khử
Bước 2: Biểu diễn quá trình oxi hóa – khử:
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa theo nguyên tắc: tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
2Cu + O2 + 2H2SO4 → 2CuSO4 + 2H2O
b)
Cách 1: 2Cu + O2 + 2H2SO4 → 2CuSO4 + 2H2O
Cứ 1 mol Cu cần dùng 1 mol H2SO4
Cách 2: Cu + 2H2SO4 (đặc) \(\xrightarrow{{{t^o}}}\) CuSO4 + SO2 + 2H2O
Cứ 1 mol Cu cần dùng 2 mol H2SO4
Theo tỉ lệ phản ứng, cách 1 sử dụng ít sulfuric acid hơn và ít gây ô nhiễm môi trường hơn. Do cách 2 sinh ra khí SO2.
Hy vọng với nội dung trong bài Giải hóa 10 bài 16 trang 78, 79 Kết nối tri thức
do thầy cô trường Trung học Bình Chánh biên soạn sẽ giúp các em nắm chắc kiến thức nội dung bài học tốt hơn để từ đó hoàn thành tất cả các bài tập trong SGK.
Đăng bởi: THCS Bình Chánh
Chuyên mục: Hóa học 10 Kết nối tri thức
- Giải Hóa 10 Bài 1 trang 13, 14, 15, 16 Kết nối tri thức
- Giải Hóa 10 Bài 2 trang 17, 18, 19, 20 Kết nối tri thức
- Giải Hóa 10 Bài 3 trang 21, 22, 23, 24, 25 Kết nối tri thức
- Giải Hóa 10 Bài 4 trang 26, 27 Kết nối tri thức
- Giải Hóa 10 Bài 5 trang 30, 31, 32, 33 Kết nối tri thức
- Giải Hóa 10 Bài 6 trang 34, 35, 36, 37, 38, 39 Kết nối tri thức