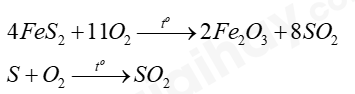Giải Hóa 10 Bài 1 trang 6, 7, 8, 9, 10 Cánh diều
Mời các em theo dõi nội dung bài học hôm nay Giải hóa 10 bài 1 trang 6, 7, 8, 9, 10 Cánh diều
Nội dung nào dưới đây thuộc đối tượng nghiên cứu của hóa học?
Hãy kể tên một số chất thông dụng xung quanh em và cho biết chất đó tạo nên từ các nguyên tử của nguyên tố nào?
Hãy cho biết loại liên kết trong phân tử nước và trong muối ăn
Bạn đang xem: Giải Hóa 10 Bài 1 trang 6, 7, 8, 9, 10 Cánh diều
CH tr 6 MĐ
|
Nội dung nào dưới đây thuộc đối tượng nghiên cứu của hóa học? (1) Sự hình thành hệ Mặt Trời (2) Cấu tạo của chất và sự biến đổi của chất. (3) Quá trình phát triển của loài người (4) Tốc độ của ánh sáng trong chân không. |
Hướng dẫn giải:
Hóa học là ngành khoa học thuộc lĩnh vực khoa học tự nhiên, nghiên cứu về thành phần, cấu trúc, tính chất, sự biến đổi của các đơn chất, hợp chất và năng lượng đi kèm những quá trình biến đổi đó.
Lời giải:
Hóa học nghiên cứu về thành phần, cấu trúc, tính chất, sự biến đổi của các đơn chất, hợp chất và năng lượng đi kèm những quá trình biến đổi đó
Đáp án (2)
CH tr 6 CH
|
Hãy kể tên một số chất thông dụng xung quanh em và cho biết chất đó tạo nên từ các nguyên tử của nguyên tố nào? |
Hướng dẫn giải:
– Chất xung quanh ta được tạo nên từ nguyên tử của các nguyên tố hóa học, được phân thành đơn chất và hợp chất.
– Nguyên tử có kích thước vô cùng nhỏ, thể hiện đầy đủ tính chất hóa học của 1 nguyên tố
Lời giải:
Một số chất thông dụng xung quanh em và nguyên tử cấu tạo nên chất đó là:
– Chất: Sắt được cấu tạo từ nguyên tử của nguyên tố sắt (Fe)
– Chất: Gang được cấu tạo từ các nguyên tử của nguyên tố: sắt (Fe), carbon (C),…
– Chất: Cồn có thành phần chính là ethanol (C2H5OH) được cấu tạo từ các nguyên tử của nguyên tố: carbon (C), oxygen (O), hydrogen (H)
– Chất: Muối ăn có công thức hóa học là NaCl được cấu tạo từ các nguyên tử của nguyên tố: sodium (Na), chlorine (Cl)
– Chất: khí oxygen (O2) được cấu tạo từ nguyên tử của nguyên tố: oxygen (O)
Chú ý:
Cần phân biệt được nguyên tử và phân tử.
Ví dụ: phân tử oxygen (O2), nguyên tử oxygen (O)
CH tr 7 CH
|
Hãy cho biết loại liên kết trong phân tử nước và trong muối ăn |
Hướng dẫn giải:
– Các loại liên kết hóa học là:
+ Liên kết ion: liên kết được hành thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu (thường là giữa kim loại và phi kim)
+ Liên kết cộng hóa trị: liên kết được tạo nên giữa 2 nguyên tử bằng 1 hay nhiều cặp electron dùng chung (thường là giữa các phi kim)
+ Liên kết kim loại: liên kết được hình thành giữa các nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của các electron tự do
Lời giải:
– Nước (H2O) tạo bởi các nguyên tử các nguyên tố oxygen (O) và hydrogen (H), đều là các phi kim có độ âm điện không chênh lệch nhau nhiều nên trong phân tử nước có liên kết cộng hóa trị.
– Muối ăn (NaCl) tạo bởi kim loại điển hình sodium (Na) và phi kim điển hình chlorine (Cl) nên trong phân tử NaCl có liên kết ion.
CH tr 7 CH
|
Do có cấu tạo khác nhau mà kim cương, than chì và than đá dù đều tạo nên từ những nguyên tử carbon nhưng lại có một số tính chất vật lí, hóa học khác nhau. Hãy nêu những tính chất khác nhau của chúng mà em biết. |
Hướng dẫn giải:
– Tính chất vật lí: màu sắc, trạng thái, tính tan, nhiệt độ sôi, nhiệt độ nóng chảy
– Tính chất hóa học: khả năng cháy, khả năng tác dụng với chất khác
Lời giải:
– Những tính chất vật lí khác nhau:
+ Kim cương: Rất cứng và giòn, hoàn toàn trong suốt, không màu và lấp lánh.
+ Than chì: Màu đen, xếp thành lớp, rất mềm, sờ vào thấy trơn.
+ Than đá (khai thác từ mỏ): Màu đen, nhìn giống nhựa.
– Những tính chất hóa học khác nhau:
+ Kim cương: Rất khó cháy, chỉ cháy trong O2 tinh khiết ở nhiệt độ cao (khoảng 800oC)
+ Than chì: Cũng khó cháy nhưng dễ hơn kim cương
+ Than đá: Dễ cháy, khi cháy có khói, có tàn
CH tr 7 VD
|
Hãy nêu một số ví dụ về phản ứng hóa học xảy ra trong tự nhiên và trong sản xuất hóa học. Vai trò và ứng dụng của chúng là gì? |
Hướng dẫn giải:
– Một số phản ứng hóa học xảy ra trong tự nhiên:
+ Phản ứng quang hợp của cây xanh dưới ánh sáng mặt trời
+ Phản ứng oxi hóa thanh sắt để lâu ngày trong không khí ẩm
– Một số phản ứng hóa học xảy ra trong sản xuất:
+ Phản ứng tạo ra SO2
+ Phản ứng tạo ra NH3
Lời giải:
– Một số phản ứng hóa học xảy ra trong tự nhiên:
+ Trong tự nhiên, phản ứng quang hợp xảy ra trong tự nhiên dưới tác dụng của ánh sáng mặt trời:
6nCO2 + 5nH2O → (C6H10O5)n + 6nO2
+ Phản ứng quang hợp có vai trò đặc biệt quan trọng, nó tạo ra O2 giúp cân bằng lượng O2 đã bị tiêu thụ cho các hoạt động sống của con người, nó cũng tạo ra tinh bột là nguồn thức ăn quan trọng.
– Một số phản ứng hóa học xảy ra trong sản xuất:
+ Trong sản xuất, phản ứng tạo ra SO2:
+ SO2 sản xuất ra có mục đích chính là sản xuất H2SO4, là hóa chất quan trọng hàng đầu trong nhiều ngành sản xuất
CH tr 7 CH
|
4. Hãy cho biết sự khác nhau giữa biến đổi hóa học và biến đổi vật lí. 5. Hãy nêu vai trò, ứng dụng của nước và oxygen mà em biết |
Hướng dẫn giải:
4.
– Biến đổi vật lí: chất vẫn giữ nguyên là chất ban đầu.
– Biến đổi hóa học: chất ban đầu bị thay đổi, chuyển hóa thành chất mới.
5.
– Oxygen:
+ Oxygen duy trì sự sống
+ Oxygen duy trì sự cháy
– Nước:
+ Sử dụng nước trong đời sống
+ Sử dụng nước trong công nghiệp
+ Sử dụng nước trong nông nghiệp
Lời giải:
4.
– Biến đổi hóa học và biến đổi vật lí đều là sự biến đổi của chất nhưng kết quả của sự biến đổi khác nhua ở điểm:
+ Biến đổi vật lí: Chất vẫn giữ nguyên là chất ban đầu
Ví dụ: Nước đá (thể rắn) nóng chảy thành nước lỏng, nước lỏng sôi thành hơi nước, trong đó nước đá, nước lỏng, hơi nước đều có công thức là H2O
+ Biến đổi hóa học: Chất ban đầu bị thay đổi, chuyển hóa thành chất mới
Ví dụ: Đốt nóng hỗn hợp bột Fe (trắng xám) và S (vàng) sẽ tạo thành chất mới FeS (đen)
5. Vai trò, ứng dụng của nước và oxygen
– Oxygen:
+ Oxygen có vai trò quyết định đối với sự sống của con người và động vật: Dùng O2 để hô hấp
+ Phần lớn (80%) lượng O2 sản xuất ra được dùng để luyện thép và công nghiệp hóa chất, từ đó sẽ tạo ra các sản phẩm phục vụ đời sống con người
+ Phần còn lại, O2 được dùng trong y khoa, hàn cắt kim loại, nhiên liệu cho tên lửa.
– Nước:
+ Nước là một phần không thể thiếu trong đời sống, mọi sinh vật đều sử dụng trực tiếp nước dưới dạng thức ăn, đồ uống
+ Nước cũng có vai trò quan trọng trong mọi ngành công nghiệp như để làm nguyên liệu, dung môi, chất rửa, chất làm lạnh…
+ Trong nông nghiệp, nước dùng để tưới cây trồng, tạo môi trường sống cho các loài sống dưới nước…
CH tr 8 VD
v
CH tr 9 VD
|
Vì sao hydrogen (H2) được coi là nhiên liệu của tương lai? |
Hướng dẫn giải:
Vì H2 cháy trong không khí (có O2) sẽ tạo ra H2O (không gây ô nhiễm môi trường)
Lời giải:
– Hydrogen (H2) được coi là nhiên liệu của tương lai vì:
+ Khi H2 cháy chỉ tạo ra H2O, không có khí thải khác gây ô nhiễm môi trường
\(2{H_2} + {O_2}\xrightarrow{{{t^o}}}2{H_2}O\)
+ H2 cũng được sản xuất từ H2O (một nguồn nguyên liệu rất dồi dào)
\(2{H_2}O\xrightarrow{{dp}}2{H_2} + {O_2}\)
CH tr 9 CH
|
Phản ứng tổng hợp NH3 từ N2 và H2 có ý nghĩa như thế nào với sự phát triển của các ngành nông nghiệp và công nghiệp |
Hướng dẫn giải:
– Nông nghiệp: Sản xuất phân đạm
– Công nghiệp: Sản xuất thuốc nổ, dược phẩm, nhiên liệu cho tên lửa, chất gây lạnh…
Lời giải:
– NH3 được dùng để sản xuất HNO3, một trong những hóa chất cơ bản, quan trọng trong công nghiệp. Từ HNO3 sẽ sản xuất ra phân đạm, thuốc nổ, dược phẩm, phẩm nhuộm…
– NH3 cũng dùng để sản xuất phân đạm, ngành công nghiệp không thể thiếu các loại phân đạm như (NH2)2CO, NH4NO3, (NH4)2SO4…
– Từ NH3 điều chế ra N2H4 làm nhiên liệu cho tên lửa
– Các máy lạnh công nghiệp dùng NH3 để làm chất gây lạnh
CH tr 10 LT
|
Vì sao khí thải chứa SO2, SO3, NO2,… cũng như nước thải chứa ion kim loại nặng như Fe3+, Cu2+,… ở một số nhà máy thường được xử lí bằng cách cho qua sữa vôi Ca(OH)2? |
Hướng dẫn giải:
– Ca(OH)2 là hóa chất rẻ tiền
– Ca(OH)2 tác dụng với khí thải tạo thành muối, tác dụng với ion kim loại nặng tạo thành các base không tan => Dễ thu gom
Lời giải:
– Ca(OH)2 là 1 hóa chất rẻ tiền, có thể được sản xuất đễ dàng từ nguyên liệu sẵn có là đá vôi (CaCO3).
– Dùng Ca(OH)2 để xử lý sơ bộ khí thải hoặc nước thải vì Ca(OH)2 chuyển hóa khí thành dạng muối, nước thải thành các kết tủa ít độc hại hơn, dễ thu gom, vận chuyển và xử lý hơn.
Lý thuyết
>> Xem chi tiết: Lý thuyết bài 1: Nhập môn Hóa học – CD
Hy vọng với nội dung trong bài Giải hóa 10 bài 1 trang 6, 7, 8, 9, 10 Cánh diều
do thầy cô trường Trung học Bình Chánh biên soạn sẽ giúp các em nắm chắc kiến thức nội dung bài học tốt hơn để từ đó hoàn thành tất cả các bài tập trong SGK.
Đăng bởi: THCS Bình Chánh
Chuyên mục: Hóa học 10 Cánh Diều
- Giải Hóa 10 Bài 2 trang 11, 12, 13, 14, 15 Cánh diều
- Giải Hóa 10 Bài 3 trang 16, 17, 18, 19, 20 Cánh diều
- Giải Hóa 10 Bài 4 trang 21, 22, 23, 24, 25 Cánh diều
- Giải Hóa 10 Bài 5 trang 26, 27, 28, 29, 30 Cánh diều
- Giải Hóa 10 Bài 6 trang 31, 32, 33, 34, 35, 36, 37 Cánh diều
- Giải Hóa 10 Bài 7 trang 38, 39, 40, 41, 42, 43, 44, 45 Cánh diều