Cách nhận biết các chất Hóa học 12
Mời các em theo dõi nội dung bài học Cách nhận biết các chất Hóa học 12 do thầy cô trường THCS Bình Chánh biên soạn sẽ giúp các em nắm chắc kiến thức nội dung bài học tốt hơn.
Cách nhận biết các chất Hóa học 12
 Thư viện Đề thi – Trắc nghiệm – Tài liệu học tập miễn phíTrang chủ: https://vndoc.com/ | Email hỗ trợ: hotro@vndoc.com | Hotline: 024 2242 6188NHẬN BIẾT – PHÂN BIỆT CÁC CHẤT HÓA HỌCI. Nguyên tắc và yêu cầu khi giải bài tập nhận biếtMuốn nhận biết hay phân biệt Muốn nhận biết hay phân biệt các chất ta phảidựa vào phản ứng đặc trưng và có các hiện tượng: như có chất kết tủa tạo thànhsau phản ứng, đổi màu dung dịch, giải phóng chất có mùi hoặc có hiện tượng sủibọt khí. Hoặc có thể sử dụng một số tính chất vật lí (nếu như bài cho phép) nhưnung ở nhiệt độ khác nhau, hoà tan các chất vào nướcPhản ứng hóa học được chọn để nhận biết là phản ứng đặc trưng, đơn giản và códấu hiệu nhận biết rõ rệt.II. Phương pháp làm bài.1) Trích thuốc thử và chất vào nhận biết vào các ống nghiệm (đánh số)2) Chọn thuốc thử thích hợp (tùy theo yêu cầu đề bài: thuốc thử tùy chọn, hạnchế hay không được dùng thuốc thử nào khác)3) Cho vào các ống nghiệm ghi nhận các hiện tượng và rút ra kết luận đã nhậnbiết, phân biệt được hóa chất nào.4) Viết PTHH minh họaIII. Các dạng bài tập thường gặp.Nhận biết các hoá chất (rắn, lỏng, khí) riêng biệt.Nhận biết các chất trong cùng một hỗn hợp.Xác định sự có mặt của các chất (hoặc các ion) trong cùng một dung dịch.
Thư viện Đề thi – Trắc nghiệm – Tài liệu học tập miễn phíTrang chủ: https://vndoc.com/ | Email hỗ trợ: hotro@vndoc.com | Hotline: 024 2242 6188NHẬN BIẾT – PHÂN BIỆT CÁC CHẤT HÓA HỌCI. Nguyên tắc và yêu cầu khi giải bài tập nhận biếtMuốn nhận biết hay phân biệt Muốn nhận biết hay phân biệt các chất ta phảidựa vào phản ứng đặc trưng và có các hiện tượng: như có chất kết tủa tạo thànhsau phản ứng, đổi màu dung dịch, giải phóng chất có mùi hoặc có hiện tượng sủibọt khí. Hoặc có thể sử dụng một số tính chất vật lí (nếu như bài cho phép) nhưnung ở nhiệt độ khác nhau, hoà tan các chất vào nướcPhản ứng hóa học được chọn để nhận biết là phản ứng đặc trưng, đơn giản và códấu hiệu nhận biết rõ rệt.II. Phương pháp làm bài.1) Trích thuốc thử và chất vào nhận biết vào các ống nghiệm (đánh số)2) Chọn thuốc thử thích hợp (tùy theo yêu cầu đề bài: thuốc thử tùy chọn, hạnchế hay không được dùng thuốc thử nào khác)3) Cho vào các ống nghiệm ghi nhận các hiện tượng và rút ra kết luận đã nhậnbiết, phân biệt được hóa chất nào.4) Viết PTHH minh họaIII. Các dạng bài tập thường gặp.Nhận biết các hoá chất (rắn, lỏng, khí) riêng biệt.Nhận biết các chất trong cùng một hỗn hợp.Xác định sự có mặt của các chất (hoặc các ion) trong cùng một dung dịch. Thư viện Đề thi – Trắc nghiệm – Tài liệu học tập miễn phíTrang chủ: https://vndoc.com/ | Email hỗ trợ: hotro@vndoc.com | Hotline: 024 2242 6188Tuỳ theo yêu cầu của bài tập mà trong mỗi dạng có thể gặp 1 trong các trườnghợp sau:+ Nhận biết với thuốc thử tự do (tuỳ chọn)+ Nhận biết với thuốc thử hạn chế (có giới hạn)
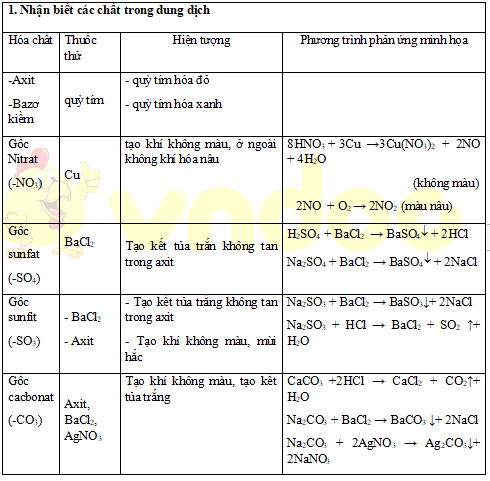
Thư viện Đề thi – Trắc nghiệm – Tài liệu học tập miễn phíTrang chủ: https://vndoc.com/ | Email hỗ trợ: hotro@vndoc.com | Hotline: 024 2242 6188Tuỳ theo yêu cầu của bài tập mà trong mỗi dạng có thể gặp 1 trong các trườnghợp sau:+ Nhận biết với thuốc thử tự do (tuỳ chọn)+ Nhận biết với thuốc thử hạn chế (có giới hạn) Thư viện Đề thi – Trắc nghiệm – Tài liệu học tập miễn phíTrang chủ: https://vndoc.com/ | Email hỗ trợ: hotro@vndoc.com | Hotline: 024 2242 61881. Nhận biết các chất trong dung dịchHóachấtThuốcthửHiện tượngPhương trình phản ứng minh họa-Axit-Bazơkiềmquỳ tím- quỳ tím hóa đỏ- quỳ tím hóa xanhGốcNitrat(-NO3)Cutạo khí không màu, ởngoài không khí hóa nâu8HNO3+ 3Cu→3Cu(NO3)2+2NO + 4H2O(khôngmàu)2NO + O2→2NO2(màu nâu)Gốcsunfat(-SO4)BaCl2Tạo kết tủa trắn không tantrong axitH2SO4+ BaCl2→BaSO4+ 2HClNa2SO4+ BaCl2→ BaSO4+2NaClGốcsunfit(-SO3)- BaCl2- Axit- Tạo kết tủa trắng khôngtan trong axit- Tạo khí không màu, mùihắcNa2SO3+ BaCl2→ BaSO3↓+2NaClNa2SO3+ HCl → BaCl2+ SO2↑+H2OGốccacbonat(-CO3)Axit,BaCl2,AgNO3Tạo khí không màu, tạokết tủa trắngCaCO3+2HCl→CaCl2+ CO2↑+H2ONa2CO3+ BaCl2→BaCO3↓+2NaClNa2CO3+ 2AgNO3→Ag2CO3↓+2NaNO3GốcphotphAgNO3Tạo kết tủa màu vàngNa3PO4+ 3AgNO3→ Ag3PO4↓ +3NaNO3
Thư viện Đề thi – Trắc nghiệm – Tài liệu học tập miễn phíTrang chủ: https://vndoc.com/ | Email hỗ trợ: hotro@vndoc.com | Hotline: 024 2242 61881. Nhận biết các chất trong dung dịchHóachấtThuốcthửHiện tượngPhương trình phản ứng minh họa-Axit-Bazơkiềmquỳ tím- quỳ tím hóa đỏ- quỳ tím hóa xanhGốcNitrat(-NO3)Cutạo khí không màu, ởngoài không khí hóa nâu8HNO3+ 3Cu→3Cu(NO3)2+2NO + 4H2O(khôngmàu)2NO + O2→2NO2(màu nâu)Gốcsunfat(-SO4)BaCl2Tạo kết tủa trắn không tantrong axitH2SO4+ BaCl2→BaSO4+ 2HClNa2SO4+ BaCl2→ BaSO4+2NaClGốcsunfit(-SO3)- BaCl2- Axit- Tạo kết tủa trắng khôngtan trong axit- Tạo khí không màu, mùihắcNa2SO3+ BaCl2→ BaSO3↓+2NaClNa2SO3+ HCl → BaCl2+ SO2↑+H2OGốccacbonat(-CO3)Axit,BaCl2,AgNO3Tạo khí không màu, tạokết tủa trắngCaCO3+2HCl→CaCl2+ CO2↑+H2ONa2CO3+ BaCl2→BaCO3↓+2NaClNa2CO3+ 2AgNO3→Ag2CO3↓+2NaNO3GốcphotphAgNO3Tạo kết tủa màu vàngNa3PO4+ 3AgNO3→ Ag3PO4↓ +3NaNO3
Cách nhận biết các chất Hóa học được THCS Bình Chánh biên soạn, gửi tới các ban nội dung khái quát cách nhận biết các chất hóa học từ năm học lớp 9 đến lớp 12 môn Hóa học, cũng là tài liệu hữu ích giúp các bạn ôn thi Trung học phổ thông Quốc gia ôn tập củng cố dạng bài tập nhận biết bằng phương pháp hóa học.
- Các công thức giải nhanh trắc nghiệm Hóa học
- Đề cương ôn thi THPT Quốc gia năm 2020 môn Hóa học
- Bộ đề ôn thi THPT Quốc gia năm 2020 môn Hóa học
NHẬN BIẾT – PHÂN BIỆT CÁC CHẤT HÓA HỌC
Bạn đang xem: Cách nhận biết các chất Hóa học 12
I. Nguyên tắc và yêu cầu khi giải bài tập nhận biết
Muốn nhận biết hay phân biệt Muốn nhận biết hay phân biệt các chất ta phải dựa vào phản ứng đặc trưng và có các hiện tượng: như có chất kết tủa tạo thành sau phản ứng, đổi màu dung dịch, giải phóng chất có mùi hoặc có hiện tượng sủi bọt khí. Hoặc có thể sử dụng một số tính chất vật lí (nếu như bài cho phép) như nung ở nhiệt độ khác nhau, hoà tan các chất vào nước
Phản ứng hóa học được chọn để nhận biết là phản ứng đặc trưng, đơn giản và có dấu hiệu nhận biết rõ rệt.
II. Phương pháp làm bài
1) Trích thuốc thử và chất vào nhận biết vào các ống nghiệm (đánh số)
2) Chọn thuốc thử thích hợp (tùy theo yêu cầu đề bài: thuốc thử tùy chọn, hạn chế hay không được dùng thuốc thử nào khác)
3) Cho vào các ống nghiệm ghi nhận các hiện tượng và rút ra kết luận đã nhận biết, phân biệt được hóa chất nào.
4) Viết PTHH minh họa
III. Các dạng bài tập thường gặp
Nhận biết các hoá chất (rắn, lỏng, khí) riêng biệt.
Nhận biết các chất trong cùng một hỗn hợp.
Xác định sự có mặt của các chất (hoặc các ion) trong cùng một dung dịch.
Tuỳ theo yêu cầu của bài tập mà trong mỗi dạng có thể gặp 1 trong các trường hợp sau:
+ Nhận biết với thuốc thử tự do (tuỳ chọn)
+ Nhận biết với thuốc thử hạn chế (có giới hạn)
+ Nhận biết không được dùng thuốc thử bên ngoài.
+ Nhận biết với thuốc thử hạn chế (có giới hạn)
+ Nhận biết không được dùng thuốc thử bên ngoài.
VI. Bài tập vận dụng
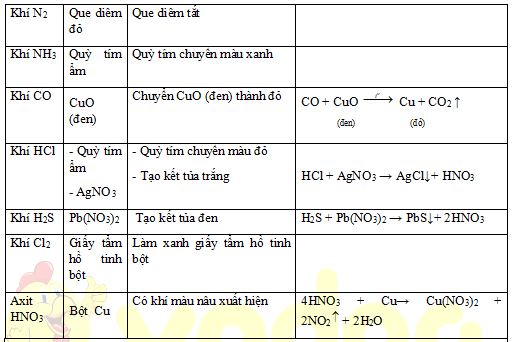
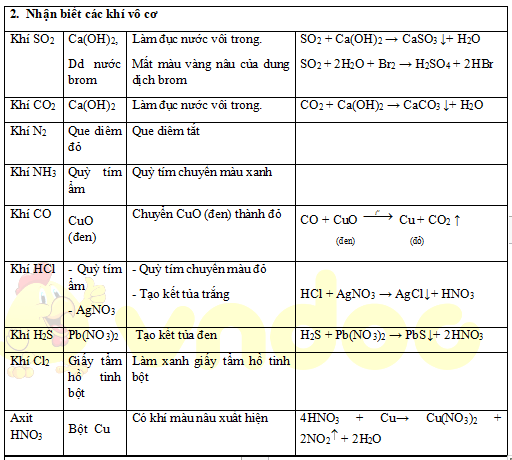
1. Nhận biết các chất vô cơ
Dạng 1: Nhận biết bằng thuốc thử tự chọn
Câu 1: Trình bày phương pháp phân biệt 5 dung dịch: HCl, NaOH, Na2SO4, NaCl, NaNO3.
Hướng dẫn giải
Trích mẫu thử và đánh số thứ tự
Nhỏ từ từ vài giọt dung dịch lên giấy quỳ tím
Nếu quỳ tím hóa đỏ: HCl
Nếu quỳ tím hóa xanh: NaOH
Quỳ tím không đổi màu: Na2SO4, NaCl, NaNO3
Cho 3 dung dịch không làm đổi màu quỳ tím tác dụng với dung dịch Ba(OH)2
Xuất hiện kết tủa trắng: Na2SO4
Na2SO4 + Ba(OH)2 → BaSO4 ↓ + 2NaOH
Không hiện tượng gì: NaCl, NaNO3
Cho 2 dung dịch còn lại tác dụng với dung dịch AgNO3
Xuất hiện kết tủa trắng: NaCl
NaCl + AgNO3 → NaNO3 + AgCl ↓
Không hiện tượng: NaNO3
Câu 2: Phân biệt 4 chất lỏng: HCl, H2SO4, HNO3, H2O.
Hướng dẫn giải
Cho quỳ tím vào 4 chất lỏng
Quỳ tím không đổi màu => H2O
Cho 3 chất còn lại tác dụng với Ba(OH)2
Ba(OH)2 + H2SO4 → BaSO4 + H2O
Xuất hiện kết tủa => H2SO4
Cho 2 chất còn lại tác dụng với dung dịch AgNO3
Xuất hiện kết tủa trắng => HCl
*Chất còn lại là HNO3
Câu 3: Có 4 ống nghiệm, mỗi ống chứa 1 dung dịch muối (không trùng kim loại cũng như gốc axit) là: clorua, sunfat, nitrat, cacbonat của các kim loại Ba, Mg, K, Pb.
a) Hỏi mỗi ống nghiệm chứa dung dịch của muối nào?
b) Nêu phương pháp phân biệt 4 ống nghiệm đó?
Hướng dẫn giải bài tập
Các kim loại và gốc không được ở cạnh nhau: Ba và sunfat, Ba và cacbonat, Mg và cacbonat, Pb và clorua, Pb và sunfat, Pb và cacbonat.
Vậy mỗi ống chứa các dd: K2CO3, Pb(NO3)2, MgSO4, BaCl2.
b,
Nhỏ dung dịch HCl vào các ống (thí nghiệm thực hiện ở nhiệt độ thấp). K2CO3 có khí không màu. Pb(NO3)2 có kết tủa trắng.
K2CO3 + 2HCl → 2KCl + CO2 + H2O
Pb(NO3)2 + 2HCl → PbCl2 + 2HNO3
Nhỏ NaOH vào 2 dd còn lại. MgSO4 kết tủa trắng. Còn lại là BaCl2.
MgSO4 + 2NaOH → Mg(OH)2 + Na2SO4
Câu 4: Phân biệt 3 loại phân bón hoá học: phân kali (KCl), đạm 2 lá (NH4NO3), và supephotphat kép Ca(H2PO4)2.
Đáp án hướng dẫn giải
Lấy một lượng nhỏ mỗi mẫu phân bón vào ống nghiệm. Thêm 4 – 5 ml nước, khuấy kĩ và lọc lấy nước lọc.
Lấy 1 ml nước lọc của từng loại phân bón vào ống nghiệm. Nhỏ vào mỗi ống vài giọt dung dịch Na2CO3, nếu có kết tủa trắng thì phân bón hoá học đó là Ca(H2PO4)2:
Na2CO3 + Ca(H2PO4)2 → CaCO3 + 2NaH2PO4
Lấy 1 ml nước lọc của hai loại phân bón còn lại, thử bằng dung dịch AgNO 3 , nếu có kết tủa trắng thì phân bón đó là KCl :
KCl + AgNO3 → AgCl + KNO3
Nước lọc nào không có phản ứng hoá học với hai thuốc thử trên là NH4NO3.
Câu 5: Có 8 dung dịch chứa: NaNO3, Mg(NO3)2, Fe(NO3)2, Cu(NO3)2, Na2SO4, MgSO4, FeSO4, CuSO4. Hãy nêu các thuốc thử và trình bày các phương án phân biệt các dung dịch nói trên.
Đáp án hướng dẫn giải
Trích mẫu thử đánh thứ tự từ 1 đến 8, cho dd BaCl2 vào các mẫu thử
- Nhóm 1: Tạo kết tủa trắng thì chất ban đầu là
Mg2SO4, FeSO4, Na2SO4, CuSO4
- Nhóm 2: Không có kết tủa thì chất ban đầu là
NaNO3, Mg(NO3)2, Fe(NO3)2, Cu(NO3)2
Cho NaOH vào nhóm 1.
+ Trường hợp tạo kết tủa trắng thì chất ban đầu là Mg(OH)2
MgSO4 + 2NaOH → Mg(OH)2 + Na2SO4
+ Trường hợp tạo kết tủa trắng xanh hóa nâu đỏ trong không khí thì chất ban đầu là FeSO4:
FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
+ Trường hợp tạo kết tủa màu xanh lam là :
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
+ Trường hợp không có hiện tượng nào xảy ra là Na2SO4.
Cho NaOH vào nhóm 2, hiện tượng tương tự như nhóm 1, giúp ta nhận biết 4 chất nhóm 2.
Câu 6: Có 4 chất rắn: KNO3, NaNO3, KCl, NaCl. Hãy nêu cách phân biệt chúng.
Đáp án hướng dẫn giải
Đem đốt bốn chất rắn trên
Muối của Na cháy với ngọn lửa màu cam (NaNO3 và NaCl) (nhóm 1)
Muối của K cháy với ngọn lửa màu tím (KNO3 và KCl) (nhóm 2)
Cho dung dịch AgNO3 vào hai nhóm 1 và 2 nếu thấy:
Có kết tủa trắng xuất hiện là NaCl và KCl
Không có hiện tượng gì là NaNO3 và KNO3
Phương trình:
AgNO3 + NaCl→ AgCl + NaNO3
AgNO3 + KCl → AgCl + KNO3
Câu 7: Bằng phương pháp hoá học hãy nhận biết các hỗn hợp sau: (Fe + Fe2O3), (Fe + FeO), (FeO + Fe2O3).
Đáp án hướng dẫn giải
Cho các hỗn hợp tác dụng với HCl:
+) Fe + Fe2O3: hiện tượng tạo ra khí không màu là H2, dung dịch màu nâu đỏ đậm sau đó nhạt dần
+) Fe + FeO: tạo khí không màu là H2, tạo dung dịch màu xanh.
+) FeO + Fe2O3: không tạo ra khí
Fe + 2HCl → FeCl2 + H2
FeO + 2HCl → FeCl2 + H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
2FeCl3 + Fe→ 3FeCl2
Câu 8: Có 3 lọ đựng ba hỗn hợp dạng bột: (Al + Al2O3), (Fe + Fe2O3), (FeO + Fe2O3). Dùng phương pháp hoá học để nhận biết chúng. Viết các phương trình phản ứng xảy ra.
Đáp án hướng dẫn giải chi tiết
| Thuốc thử | (Al + Al2O3) | (Fe + Fe2O3) | (FeO + Fe2O3) |
| Dung dịch NaOH | Khí bay lên | – | – |
| Dung dịch HCl | – | Khí bay lên | – |
Phương trình hóa học xảy ra
Al + NaOH + H2O → NaAlO2 + H2↑
Al2O3 + NaOH → NaAlO2 + H2O
Fe + HCl → FeCl2 + H2↑
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
FeO + 2HCl → FeCl2 + H2O
Dạng 2: Nhận biết chỉ bằng thuốc thử quy định
Câu 1: Nhận biết các dung dịch trong mỗi cặp sau đây chỉ bằng dung dịch HCl:
a) 4 dung dịch: MgSO4, NaOH, BaCl2, NaCl.
b) 4 chất rắn: NaCl, Na2CO3, BaCO3, BaSO4.
Câu 2: Nhận biết bằng 1 hoá chất tự chọn:
a) 4 dung dịch: MgCl2, FeCl2, FeCl3, AlCl3.
b) 4 dung dịch: H2SO4, Na2SO4, Na2CO3, MgSO4.
c) 4 axit: HCl, HNO3, H2SO4, H3PO4.
Câu 3: Chỉ được dùng thêm quỳ tím và các ống nghiệm, hãy chỉ rõ phương pháp nhận ra các dung
dịch bị mất nhãn: NaHSO4, Na2CO3, Na2SO3, BaCl2, Na2S.
Câu 4: Cho các hoá chất: Na, MgCl2, FeCl2, FeCl3, AlCl3. Chỉ dùng thêm nước hãy nhận biết chúng.
Dạng 3. Nhận biết không có thuốc thử khác
Câu 1: Có 4 ống nghiệm được đánh số (1), (2), (3), (4), mỗi ống chứa một trong 4 dung dịch sau: Na2CO3, MgCl2, HCl, KHCO3. Biết rằng:
Khi đổ ống số (1) vào ống số (3) thì thấy kết tủa.
Khi đổ ống số (3) vào ống số (4) thì thấy có khí bay lên.
Hỏi dung dịch nào được chứa trong từng ống nghiệm.
Câu 2: Trong 5 dung dịch ký hiệu A, B, C, D, E chứa Na2CO3, HCl, BaCl2, H2SO4, NaCl. Biết:
Đổ A vào B có kết tủa.
Đổ A vào C có khí bay ra.
Đổ B vào D có kết tủa.
Xác định các chất có các kí hiệu trên và giải thích.
Câu 3: Có 4 lọ mất nhãn A, B, C, D chứa KI, HI, AgNO3, Na2CO3.
+ Cho chất trong lọ A vào các lọ: B, C, D đều thấy có kết tủa.
+ Chất trong lọ B chỉ tạo kết tủa với 1 trong 3 chất còn lại.
+ Chất C tạo 1 kết tủa và 1 khí bay ra với 2 trong 3 chất còn lại.
Xác định chất chứa trong mỗi lọ. Giải thích?
Câu 4: Hãy phân biệt các chất trong mỗi cặp dung dịch sau đây mà không dùng thuốc thử khác:
a) NaCl, H2SO4, CuSO4, BaCl2, NaOH.
b) NaOH, FeCl2, HCl, NaCl.
Câu 5: Không được dùng thêm hoá chất nào khác, hãy nhận biết các chất đựng trong các lọ mất nhãn sau: KOH, HCl, FeCl3, Pb(NO3)2, Al(NO3)3, NH4Cl.
Câu 6: Không được dùng thêm hoá chất nào khác, hãy nhận biết 5 lọ mất nhãn sau: NaHSO4, Mg(HCO3)2, Ca(HCO3)2, Na2CO3, KHCO3.
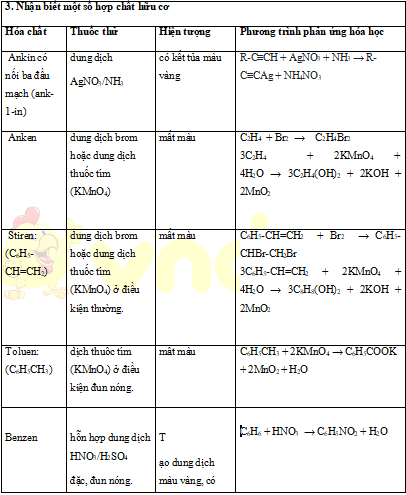
2. Nhận biết các chất hữu cơ
Câu 1: Dùng một hoá chất nào sau đây để nhận biết stiren, toluen, phenol
Câu 2: Có 4 chất lỏng đựng trong 4 lọ bị mất nhãn: ancol etylic, toluen, phenol, axit fomic. Để nhận biết 4 chất đó có thể dùng nhóm thuốc thử nào sau đây?
Câu 3: Chỉ dùng thêm một chất nào trong các chất dưới đây để nhận biết các chất: ancol etylic, axit axetic, glixerol, glucozơ đựng trong 4 lọ mất nhãn?
Câu 4: Để loại bỏ SO2 có lẫn trong C2H4 người ta cho hỗn hợp khí qua dung dịch
Câu 5: Để loại bỏ tạp chất C2H2, C2H4, but-1,3-đien, CH3NH2 có lẫn trong C2H6 ta cho hỗn hợp lần lượt đi qua dung dịch
Câu 6: Khi làm khan rượu C2H5OH có lẫn một ít nước người ta dùng cách nào sau đây?
Câu 7: Hỗn hợp gồm benzen, phenol và anilin. Để lấy riêng từng chất nguyên chất cần dùng
Câu 8: Để tách các chất trong hh gồm ancol etylic, anđehit axetic, axit axetic cần dùng các dd
Câu 9: Để tách riêng lấy từng chất từ hỗn hợp gồm benzen, anilin, phenol, ta có thể dùng thêm các dung dịch
Câu 10: Để tách riêng từng chất benzen (ts =800C) và axit axetic (ts =1180C) nên dùng phương pháp nào sau đây?
Tài liệu vẫn còn xin vui lòng ấn link bên dưới xem thêm thêm tài liệu
Cách nhận biết các chất Hóa học được THCS Bình Chánh biên soạn là tài liệu hữu ích dành tặng các bạn học sinh đang theo học môn Hóa học. Bằng phương pháp hóa học nhận biết các chất là nội dung chính đưa ra, bài viết được chia thành các mục rõ ràng. Tóm tắt phương pháp, lý thuyết chia thành 2 dạng: cách nhận biết các chất hóa học vô cơ, cách nhận biết các chất hóa học hữu cơ, hy vọng tài liệu có thể giúp ích cho các bạn, đặc biệt các biệt đang ôn thi Trung học phổ thông Quốc gia.
Trên đây THCS Bình Chánh đã giới thiệu Cách nhận biết các chất Hóa học tới các bạn. Để có kết quả học tập tốt và hiệu quả hơn, THCS Bình Chánh xin giới thiệu tới các bạn học sinh tài liệu, Chuyên đề Hóa học 10, Chuyên đề Hóa học 11, Chuyên đề Hóa học 12. Tài liệu học tập lớp 12 mà THCS Bình Chánh tổng hợp biên soạn và đăng tải.
Ngoài ra, THCS Bình Chánh.com đã thành lập group chia sẻ tài liệu học tập học tập miễn phí trên Facebook: Tài Liệu Học Tập THCS Bình Chánh.com Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.
Đăng bởi: THCS Bình Chánh
Chuyên mục: Học Tập
- Cao Bá Quát là ai? Những chuyện ít người biết về Cao Bá Quát
- “Mỗi người sinh ra đều là thiên tai” (An-be Anh-xtanh). Em hiểu câu nói này như thế nào? Hãy trình bày cách hiểu của mình cho các bạn cùng nghe (13 mẫu)
- 1 đại đội có bao nhiêu người? Các đại đội của Quân đội Nhân dân Việt Nam
- 1 Lunatic 1 Ice Pick là gì? Video gây án khiến cả thế giới phải rúng động
- 100 Hình ảnh triết lý cuộc sống đẹp, muôn đời có giá trị
- 100+ ảnh hoạt hình buồn khóc gửi gắm tâm trạng, nỗi niềm
- 100+ Ca dao tục ngữ về thầy cô hay và ý nghĩa
- 1000 Hình ảnh dễ thương, cute nhất hiện nay giới trẻ săn lùng