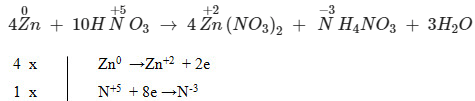Zn + HNO3 → Zn(NO3)2 + NH4NO3 + H2O
Mời các em theo dõi nội dung bài học Zn + HNO3 → Zn(NO3)2 + NH4NO3 + H2O do thầy cô trường THCS Bình Chánh biên soạn sẽ giúp các em nắm chắc kiến thức nội dung bài học tốt hơn.
Zn + HNO3 → Zn(NO3)2 + NH4NO3 + H2O
Zn + HNO3 → Zn(NO3)2 + NH4NO3 + H2O được THCS Bình Chánh biên soạn hướng dẫn các bạn học sinh viết và cân bằng phản ứng Zn tác dụng HNO3 loãng sản phẩm thu được muối NH4NO3. Hy vọng với hướng dẫn chi tiết các bước cân bằng các bạn học sinh sẽ biết cách vận dụng làm các dạng bài tập tương tự. Mời các bạn tham khảo.
1. Phương trình phản ứng Zn tác dụng HNO3
4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O
2. Hướng dẫn chi tiết cân bằng phản ứng Zn tác dụng HNO3
Bạn đang xem: Zn + HNO3 → Zn(NO3)2 + NH4NO3 + H2O
4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O
3. Điều kiện phản ứng xảy ra giữa Zn và HNO3
Nhiệt độ thường
4. Phương trình ion rút gọn Zn + HNO3
Phương trình phân tử phản ứng Zn tác dụng HNO3
4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O
Phương trình ion rút gọn:
4Zn + 10H+ + NO3– → 4Zn2+ + NH4+ + 3H2O
5. Bài tập vận dụng liên quan
Câu 1. Cho hỗn hợp gồm AlCl3 và ZnCl2 tác dụng với dung dịch NH3 dư thu được kết tủa X. Lọc lấy X rồi đem nung thu được chất rắn Y. Cho khí H2 dư đi qua Y nung nóng thu được chất rắn gồm
A. Al và Zn
B. Al2O3
C. Al và ZnO
D. Al2O3 và Zn
Xem đáp ánĐáp án C
Phương trình hóa học minh họa
AlCl3 + 3NH3 + 6H2O → Al(OH)3 + 3NH4Cl
ZnCl2 + 2NH3 + 2H2O → Zn(OH)2 + 2NH4Cl
Zn(OH)2 + NH3 dư → [Zn(NH3)6](OH)2
Câu 2. Cho phương trình hóa học: Zn + HNO3 → Zn(NO3)2 + NH4NO3 + H2O
Tổng hệ số của phương trình là
A. 22.
B. 24.
C. 25.
D. 26.
Xem đáp ánĐáp án A
Phương trình phản ứng minh họa
4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O
Tổng hệ số của phương trình là 22.
Câu 3. Hoà tan hết hỗn hợp X gồm Zn và ZnO trong dung dịch HNO3 loãng dư thấy không có khí bay ra và trong dung dịch chứa 113,4 gam Zn(NO3)2 và 8 gam NH4NO3. Phần trăm khối lượng Zn trong X là
A. 33,33%
B. 66,67%
C. 61,61%
D. 50,00%
Xem đáp ánĐáp án C
nZn(NO3)2 = 0,6 mol; nNH4NO3 = 0,1 mol
ZnO tác dụng với HNO3 không sinh ra sản phẩm khử vì đã đạt số oxi hóa tối đa
Bảo toàn e: 2.nZn = 8.nNH4NO3 => nZn = 4.0,1 = 0,4 mol
Bảo toàn nguyên tố Zn: nZn(NO3)2 = nZn + nZnO => nZnO = 0,6 – 0,4 = 0,2 mol
%mZn = (0,4.65)/(0,4.65 + 0,2.81).100%=61,61%
Đáp án cần chọn là: C
Câu 4. Hòa tan hoàn toàn 13,00 gam Zn trong dung dịch HNO3 loãng, dư thu được dung dịch X và 0,448 lít khí X duy nhất (đktc). Cô cạn dung dịch X thu được 39,8 gam chất rắn. Khí X là:
A. NO2
B. N2
C. N2O
D. NO
Xem đáp ánĐáp án B
Chất rắn khan thu được chứa Zn(NO3)2 và có thể có NH4NO3.
Ta có: nZn(NO3)2 = nZn = 0,2 mol
Giả sử 1 phân tử khí trao đổi n electron.
BT electron: n e cho = n e nhận => 2nZn = 8nNH4NO3 + n.n khí => 2.0,2 = 8.0,025 + n.0,02
=> n = 10 => X là N2
Câu 5. Dãy các hợp chất vừa tác dụng được với dung dịch HCl vừa tác dụng với dung dịch NaOH là:
A. AlCl3, Al2O3, Al(OH)3
B. Al2O3, Al(OH)3, NaHCO3
C. Zn(OH)2, Al2O3, Na2CO3
D. ZnO, Zn(OH)2, NH4Cl
Xem đáp ánĐáp án B
Al2O3, Al(OH)3, NaHCO3 là các chất lưỡng tính nên vừa tác dụng được với dung dịch HCl vừa tác dụng với dung dịch NaOH.
Al2O3 + 6HCl → 2AlCl3 + 3 H2O
Al2O3+2NaOH→2NaAlO2 +H2O
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Al(OH)3 + NaOH → NaAlO2 + 2H2O
NaHCO3+ HCl → NaCl + CO2+ H2O
NaHCO3+ NaOH → Na2CO3+ H2O
Câu 6. Cho m gam bột Zn vào 500 ml dung dịch Fe2(SO4)3 0,24M. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng dung dịch tăng thêm 9,6 gam so với khối lượng dung dịch ban đầu. Giá trị của m là
A. 29,25.
B. 48,75.
C. 32,50.
D. 20,80.
Xem đáp ánĐáp án D
nFe2(SO4)3 = 0,24.0,5 = 0,12mol
nFe3+= 0,24 mol
Zn + 2Fe3+ → Zn2+ + 2Fe2+
0,12….0,24…………….0,24
Zn + Fe2+ → Zn2+ + Fe
x……………………x
→ mdd tăng = mZn – mFe= 65.(0,12 + x) – 56x = 9,6 → x = 0,2
=> nZn ban đầu = 0,12 + 0,2 = 0,23 mol
=> mZn = 0,32.65 = 20,8 gam
Câu 7. Tiến hành các thí nghiệm sau:
(1) Cho Zn vào dung dịch Fe2(SO4)3 dư.
(2) Cho bột Mg vào lượng dư dung dịch HCl.
(3) Dẫn khí H2 dư qua ống sứ chứa bột Fe2O3 nung nóng.
(4) Cho Ca vào lượng dư dung dịch CuSO4.
(5) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3.
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kim loại là
A. 4
B. 2
C. 3
D. 1
Xem đáp ánĐáp án B
(1) Zn + Fe2(SO4)3 dư → ZnSO4 + 2FeSO4 => không thu được kim loại
(2) Mg + 2HCl dư → MgCl2 + H2 => không thu được kim loại
(3) H2 dư + Fe2O3 → Fe + H2O => thu được kim loại Cu
(4) Ca + 2H2O → Ca(OH)2 + H2
CuSO4 + Ca(OH)2 → Cu(OH)2 + CaSO4
=> không thu được kim loại
(5) Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag => thu được kim loại Ag
Vậy có 2 thí nghiệm thu được kim loại sau phản ứng là (3) và (5)
Câu 8. Để khử hoàn toàn hỗn hợp FeO và ZnO thành kim loại cần 4,48 lít H2 (đktc). Nếu đem hỗn hợp kim loại thu được hòa tan hoàn toàn bằng dung dịch HCl thì thể tích H2 (đktc) thu được là:
A. 4,48 lít
B. 2,24 lít
C. 3,36 lít
D. 1,12 lít
Xem đáp ánĐáp án A
nhh oxit = nH2 = nhh kim loại = 0,2 mol
Khi hoà tan hỗn hợp kim loại cùng hóa trị II vào axit thì:
nH2 = nhh kim loại = 0,2 mol
VH2 = 22,4.0,2 = 4,48 lít
Câu 9. Cho m gam hỗn hợp hai kim loại Fe, Zn tác dụng hết với 200 ml dung dịch HCl 1,6M thoát ra 3,36 lít (đktc) khí H2. Dung dịch thu được có giá trị pH là (bỏ qua các quá trình thuỷ phân của muối)
A. 2.
B. 7.
C. 4.
D. 1.
Xem đáp ánĐáp án D
nkhí = 0,15 mol → nHCl pư = 2.nkhí = 0,3 mol
nHCl dư = 0,2.1,6 – 0,3 = 0,02 mol
→ CM (HCl dư) = 0,02 : 0,2 = 0,1M → pH = 1.
Câu 10. Cho 500ml dung dịch NaOH 1M tác dụng với 200 ml dung dịch ZnSO4 1M, sau phản ứng thu được a gam kết tủa . Giá trị của a là
A. 9,425.
B. 8,425.
C. 7,425.
D. 14,855
Xem đáp ánĐáp án D
nOH– = nNaOH = 0,5.1 = 0,5 mol
nZn2+ = nZnCl2 = 0,2.1 = 0,2 mol
Phương trình hóa học:
2NaOH + ZnSO4 → Zn(OH)2↓ + Na2SO4 (1)
(0,5) (0,2) (0,2 mol)
NaOH dư 0,1 mol, tiếp tục có phản ứng:
2NaOH + Zn(OH)2 → Na2[Zn(OH)4] (2)
(0,1) (0,1 mol)
Sau phản ứng (1) và (2) n↓ = 0,2 – 0,05 = 0,15 mol
→ m↓ = a = 0,15.99 = 14,85 g
Câu 11. Cho V lít dung dịch NaOH 2M vào 500ml dung dịch ZnCl2 0,4M, sau phản ứng thu được 9,9 gam kết tủa. Giá trị của V là
A. 0,1 hoặc 0,3.
B. 0,1.
C. 0,05.
D. 0,05 và 0,15.
Xem đáp ánĐáp án A
nOH– = nNaOH = 2V mol
nZn2+ = nZnCl2 = 0,5. 0,4 = 0,2 mol
n↓ = 9,9/99 = 0,1 mol
Phương trình hóa học
2NaOH + ZnCl2 → Zn(OH)2↓ + 2NaCl (1)
2NaOH + Zn(OH)2 → Na2[Zn(OH)4] (2)
Ta có: n↓ = 0,1 < nZn2+ → Có 2 trường hợp xảy ra
Trường hợp 1: NaOH hết; ZnCl2 dư
Theo (1) → nOH– = 2n↓ = 0,2 mol
→ V = 0,2 : 2 = 0,1 lít
Trường hợp 2: NaOH và ZnCl2 đều hết và kết tủa tan một phần.
Theo (1) và (2) → nOH- = 4nZn2+ – 2n↓ = 0,6 mol
→ V = 0,6 : 2 = 0,3 lít
Vậy thể tích dung dịch NaOH 2M cần dùng là 0,1 lít hoặc 0,3 lít.
Câu 12. Cho một lượng bột Zn vào dung dịch X gồm FeCl2 và CuCl2. Khối lượng chất rắn sau khi các phản ứng xảy ra hoàn toàn nhỏ hơn khối lượng bột Zn ban đầu là 0,5 gam. Cô cạn phần dung dịch sau phản ứng thu được 13,6 gam muối khan. Tổng khối lượng các muối trong X là
A.13,1 gam.
B.17,0 gam.
C.19,5 gam.
D.14,1 gam.
Xem đáp ánĐáp án A
mdd tăng = mrắn giảm = 0,5 gam → mdd ban đầu = 13,6 – 0,5 = 13,1 gam
Câu 13. Cho 5,62 gam hỗn hợp gồm 3 oxit Fe2O3, MgO, ZnO tan vừa đủ trong 600ml dung dịch H2SO4 0,1M thì khối lượng muối sunfat khan tạo thành là:
A. 5,33 gam
B. 5,21 gam
C. 10,42 gam
D. 5,68 gam.
Xem đáp ánĐáp án C
nH2SO4 = 0,06 (mol)
Áp dụng phương pháp tăng giảm khối lượng:
mmuối = moxit + 0,06.( 96 – 16) = 5,62 + 0,06.80 = 10,42 gam
Câu 14. Oxi hóa hoàn toàn 30,2 gam hỗn hợp bột các kim loại Cu, Zn, Al bằng oxi thu được 44,6 gam hỗn hợp các oxit. Cho lượng oxit này tan trong dung dịch HCl. Khối lượng muối khan thu được là:
A. 47,05
B. 63,90
C. 94,10
D. 37,30
Xem đáp ánĐáp án C
mO(oxit) = moxit – m kim loại = 44,6 – 30,2 = 14,4 gam
nO(oxit) = 0,9 mol => nCl-= 2.0,9 = 1,8 mol
m muối= mkim loại + mCl-= 30,2 + 1,8.35,3 = 94,1 gam
Câu 15. Chất oxi hoá là chất
A. cho electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
B. cho electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
C. nhận electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
D. nhận electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
Xem đáp ánĐáp án D
Câu 16. Cho các phản ứng oxi hoá- khử sau:
3I2 + 3H2O → HIO3 + 5HI (1)
HgO → 2Hg + O2 (2)
4K2SO3 → 3K2SO4 + K2S (3)
NH4NO3 → N2O + 2H2O (4)
2KClO3 → 2KCl + 3O2 (5)
3NO2 + H2O → 2HNO3 + NO (6)
4HClO4 → 2Cl2 + 7O2 + 2H2O (7)
2H2O2 → 2H2O + O2 (8)
Cl2 + Ca(OH)2 → CaOCl2 + H2O (9)
KMnO4 → K2MnO4 + MnO2 + O2 (10)
Trong số các phản ứng oxi hoá- khử trên, số phản ứng oxi hoá- khử nội phân tử là
A. 2.
B. 3.
C. 4.
D. 5.
Xem đáp ánĐáp án D
………………………………………….
>> Mời các bạn tham khảo thêm tài liệu liên quan
- Zn + H2SO4 → ZnSO4 + H2
- Zn + H2SO4 → ZnSO4 + SO2 + H2O
- Zn + HNO3 → Zn(NO3)2 + NO2 + H2O
- Zn + HNO3 → Zn(NO3)2 + NO + H2O
- Zn + HNO3 → Zn(NO3)2 + N2 + H2O
- Zn + HCl → ZnCl2 + H2
- Zn + CuSO4 → ZnSO4 + Cu
- Zn + NaOH + H2O → Na2[Zn(OH)4] + H2
THCS Bình Chánh đã gửi tới bạn Zn + HNO3 → Zn(NO3)2 + NH4NO3 + H2O được THCS Bình Chánh biên soạn. Nội dung tài liệu giúp các bạn biết cách viết và cân bằng phương trình phản ứng khi cho Zn tác dụng với HNO3 loãng, sản phẩm sau phản ứng thu được muối NH4NO3.
Các bạn có thể các em cùng tham khảo thêm một số tài liệu liên quan hữu ích trong quá trình học tập như: Giải bài tập Hóa 12, Giải bài tập Toán lớp 12, Giải bài tập Vật Lí 12 ,….
Ngoài ra, THCS Bình Chánh.com đã thành lập group chia sẻ tài liệu ôn tập THPT Quốc gia miễn phí trên Facebook: Tài liệu học tập lớp 12 Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu, đề thi mới nhất.
Đăng bởi: THCS Bình Chánh
Chuyên mục: Học Tập