Tính chất hóa học của Sắt
Mời các em theo dõi nội dung bài học Tính chất hóa học của Sắt do thầy cô trường THCS Bình Chánh biên soạn sẽ giúp các em nắm chắc kiến thức nội dung bài học tốt hơn.
Tính chất hóa học của Sắt
Tính chất hóa học của Sắt được THCS Bình Chánh sưu tầm và đăng tải, tổng hợp các câu hỏi lí thuyết trong chương trình giảng dạy môn Hóa học. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
I. Định nghĩa
– Sắt là tên một nguyên tố hóa học trong bảng tuần hoàn nguyên tố có ký hiệu Fe và số hiệu nguyên tử bằng 26. Sắt là nguyên tố có nhiều trên Trái Đất, cấu thành lớp vỏ ngoài và trong của lõi Trái Đất.
Bạn đang xem: Tính chất hóa học của Sắt
– Kí hiệu: Fe
– Cấu hình electron: 1s22s22p63s23p63d64s2 hoặc [Ar]3d64s2
– Số hiệu nguyên tử: 26
– Khối lượng nguyên tử: 56 g/mol
– Vị trí trong bảng tuần hoàn
+ Ô: số 26
+ Nhóm: VIIIB
+ Chu kì: 4
– Đồng vị: sắt có nhiều đồng vị như 55Fe, 56Fe, 58Fe, 59Fe
– Độ âm điện: 1,83
II. Tính chất vật lý & nhận biết
1. Tính chất vật lí:
– Sắt là kim loại màu trắng hơi xám, dẻo, dai, dễ rèn, nhiệt độ nóng chảy khá cao (1540oC)
– Dẫn nhiệt, dẫn điện tốt, có tính nhiễm từ.
2. Nhận biết
– Sắt có tính nhiễm từ nên bị nam châm hút.
III. Tính chất hóa học
– Sắt là kim loại có tính khử trung bình, tùy theo các chất oxi hóa mà sắt có thể bị oxi hóa lên mức +2 hay +3.
Fe → Fe2+ + 2e
Fe → Fe3+ + 3e
1. Tác dụng với phi kim
a, Tác dụng với lưu huỳnh
b, Tác dụng với oxi
c, Tác dụng với clo
2. Tác dụng với axit
a. Tác dụng với dung dịch axit HCl, H2SO4 loãng
Fe + 2H+ → Fe2+ + H2
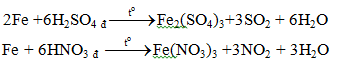
b. Với các axit HNO3, H2SO4đặc
Fe + 4HNO3 l → Fe(NO3)3 + NO + 2H2O
Chú ý: Với HNO3 đặc, nguội; H2SO4 đặc, nguội: Fe bị thụ động hóa.
3. Tác dụng với dung dịch muối
– Fe đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng:
Fe+ CuSO4 → FeSO4 + Cu
Chú ý:
Fe + 2Ag+ → Fe2+ + 2Ag
Ag+ dư + Fe2+ → Fe3+ + Ag
IV. Trạng thái tự nhiên
– Trong tự nhiên sắt tồn tại ở dạng hợp chất, trong các quặng sắt.
– Các quặng sắt:
+ Hematit: Hematit đỏ (Fe2O3 khan) và Hematit nâu (Fe2O3.nH2O).
+ Manhetit (Fe3O4)
+ Xiđerit (FeCO3)
+ Pirit (FeS2)
– Sắt còn có trong hồng cầu của máu, giúp vận chuyển oxi tới các tế bào.
V. Điều chế
– Sắt được điều chế theo phương pháp nhiệt luyện.
Fe2O3 + 3CO → 2Fe + 3CO2
VI. Ứng dụng
– Phần lớn sắt được sử dụng để luyện thép, gang.
– Ứng dụng trong nhiều vật dụng đời sống như oto, xe máy……
VII. Các hợp chất quan trọng của Fe
Hợp chất sắt (II)
- Sắt (II) oxit (FeO)
- Sắt (II) hiđroxit (Fe(OH)2)
- Muối sắt (II) (Fe2+: FeCl2, Fe(NO3)2….)
Hợp chất sắt (III)
- Sắt (III) oxit (Fe2O3)
- Sắt (III) hiđroxit (Fe(OH)3)
- Muối sắt (III) Fe3+: FeCl3, Fe(NO3)3….)
Tính chất hóa học của Sắt trên đây được THCS Bình Chánh sưu tầm và giới thiệu nhằm giúp các em học sinh hiểu rõ hơn về tính chất hóa học, vật lí, nhận biết, điều chế và ứng dụng của tất cả các đơn chất, hợp chất hóa học đã học trong chương trình Hóa học.
Đăng bởi: THCS Bình Chánh
Chuyên mục: Học Tập
- 1 đại đội có bao nhiêu người? Các đại đội của Quân đội Nhân dân Việt Nam
- 1 Lunatic 1 Ice Pick là gì? Video gây án khiến cả thế giới phải rúng động
- 100+ Ca dao tục ngữ về thầy cô hay và ý nghĩa
- 1001+ Hình ảnh có chữ buồn tâm trạng bạn gửi gắm nỗi lòng
- 12 mẫu mở bài Chiều tối hay nhất
- 20 mẫu kết bài Chiếc thuyền ngoài xa hay nhất
- 2011 là năm con gì? Sinh năm 2011 mệnh gì?
- 50+ Những câu nói hay của thầy Thích Nhất Hạnh về tình yêu và sự thấu hiểu