Mời các em theo dõi nội dung bài học về Điện tích hạt nhân là gì? Cách tính điện tích hạt nhân do thầy cô trường THCS Bình Chánh biên soạn. Hy vọng sẽ là tài liệu hữu ích giúp các em học tốt và hoàn thành tốt bài tập của mình.
Mục lục
Điện tích hạt nhân là gì?
Điện tích hạt nhân chính là số Proton có trong hạt nhân. Nếu hạt nhân nguyên tử có Z Proton thì điện tích hạt nhân là Z+ Nguyên tử cầu tạo bởi hạt nhân ở chính giữa mang điện tích dương và các đám mây Electron xung quanh.
Nguyên tử là những hạt vô cùng nhỏ và trung hòa về điện. Tức là Số Proton = Số Electron
Bạn đang xem: Điện tích hạt nhân là gì? Cách tính điện tích hạt nhân
Số hiệu nguyên tử của một nguyên tố hóa học cũng chính là số đơn vị điện tích hạt nhân nguyên tử của nguyên tố đó. Số Khối A = Số P + Số N
Ví Dụ : Nguyên tố Natri :
+ Số hiệu nguyên tử của nguyên tố Natri là 11.
+ Điện tích hạt nhân của nguyên tử là 11
+. Trong đó có 11 Protron và 12 Neutron
+Nguyên tử Natri có 11 Electron chuyển động quanh hạt nhân
+ Khối lượng nguyên tử Natri là 23 đvC

Cách xác định điện tích hạt nhân nguyên tử
Hạt nhân có Z proton thì điện tích hạt nhân bằng Z+ và số đơn vị điện tích hạt nhân bằng Z.
Trong nguyên tử: Z = P = E
Trong đó: + Z là số đơn vị điện tích hạt nhân.
+ P là số tổng số proton có trong nguyên tử
+ E là tổng số electron có trong nguyên tử.
– Ví dụ:
+ Nguyên tử oxi có 8 proton, thì điện tích hạt nhân bằng 8+ và số đơn vị điện tích hạt nhân bằng 8.
+ Số đơn vị điện tích hạt nhân nguyên tử cacbon là 6, vậy nguyên tử cacbon có 6 proton và 6 electron.
Cách tính điện tích hạt nhân
Điện tích hạt nhân
– Proton mang điện tích 1+
=> Có Z proton thì điện tích của hạt nhân bằng Z+ và số đơn vị điện tích hạt nhân bằng Z.
– Nguyên tử trung hoà về điện nên số proton trong hạt nhân bằng số electron của nguyên tử
Số đơn vị điện tích hạt nhân Z = số proton = số electron
Ví dụ:
Nguyên tử Na có: Z =13 => Nguyên tử Na có 13 proton và 13 electron.
Số đơn vị điện tích hạt nhân có trong nguyên tử Oxi là 8. Vậy nguyên tử Oxi sẽ có 8 proton và 8 electron.
Vậy, có tính số đơn vị điện tích hạt nhân z thông qua số proton hoặc electron
Chuẩn bị sẵn bảng tuần hoàn các nguyên tố hóa học.
Bảng tuần hoàn các nguyên tố hóa học (gọi tắt là bảng tuần hoàn) là một bảng sắp xếp các nguyên tố theo cấu trúc hạt nhân của chúng. Trong bảng tuần hoàn, các nguyên tố thường được phân chia theo màu sắc và có ký hiệu hóa học rút ngọn gồm 1, 2 đến 3 chữ cái. Các thông tin khác về nguyên tố được đề cập trong bảng tuần hoàn là khối lượng nguyên tử và số hiệu nguyên tử.
– Bảng tuần hoàn thường được đính kèm theo sách giáo khoa, bạn cũng có thể tìm trên mạng hoặc mua ở hiệu sách.
– Trong bài kiểm tra, một số giáo viên có thể cho sẵn bảng tuần hoàn.
Xác định vị trí nguyên tố bạn muốn tìm trong bảng tuần hoàn.
Bảng tuần hoàn sắp xếp cách nguyên tố theo số hiệu nguyên tử và phân chia chúng thành ba nhóm chính: kim loại, phi kim và á kim. Ngoài ra còn có các nhóm kim loại kiềm, halogen và khí hiếm.
– Sử dụng nhóm (cột) hoặc chu kỳ (hàng) để xác định vị trí của nguyên tố cần tìm hiểu trong bảng tuần hoàn.
– Bạn cũng có thể tìm nguyên tố theo ký hiệu hóa học nếu bạn không biết thêm thông tin gì về nguyên tố đó.
Xác định vị trí nguyên tố theo số hiệu nguyên tử.
Số hiệu nguyên tử thường được viết góc trên bên trái ký hiệu hóa học của nguyên tố. Số hiệu nguyên tử cung cấp thông tin về số proton cấu thành một nguyên tử của nguyên tố đó.
– Ví dụ, Bo (B) có số hiệu nguyên tử là 5, tức là nguyên tử của nguyên tố này có 5 proton.
Xác định số electron.
Proton là hạt mang điện tich dương nằm trong hạt nhân. Electron là hạt mang điện tích âm. Vì thế, một nguyên tố ở trạng thái trung hòa về điện tích sẽ có số proton và electron bằng nhau.
– Ví dụ, Bo (B) có số hiệu nguyên tử là 5, tức là nguyên tử của nguyên tố này có 5 proton và 5 electron.
– Tuy nhiên, nếu nguyên tố có một ion dương hoặc một ion âm thì số proton và số electron sẽ không bằng nhau. Lúc này, bạn cần thực hiện các tính toán cần thiết để xác định được số lượng mỗi loại hạt. Số ion được biểu thị dưới dạng chữ số nhỏ ở phía trên bên phải (giống số mũ) của nguyên tố.
Tìm nguyên tử khối của nguyên tố.
Để tính được số nơ-tron, trước tiên bạn cần xác định được nguyên tử khối của nguyên tố đó. Nguyên tử khối của một nguyên tố (cũng chính là khối lượng nguyên tử của nguyên tố) là khối lượng trung bình của các nguyên tử của một nguyên tố. Số khối thường được viết ngay phái dưới ký hiệu hóa học của nguyên tố.
– Bạn cần làm tròn nguyên tử khối. Ví dụ, nguyên tử khối của Bo là 10,811, để tính số nơ-tron, bạn có thể làm tròn thành 11.
Lấy nguyên tử khối trừ đi số hiệu nguyên tử.
Số nơ-tron được tính bằng hiệu của nguyên tử khối và số hiệu nguyên tử. Bạn cần nhớ rằng số hiệu nguyên tử tương đương với số proton, giá trị này đã được xác định ở bước trước.
– Trong ví dụ về nguyên tố Bo, ta có số nơ-tron được tính bằng: 11 (nguyên tử khối) – 5 (số hiệu nguyên tử) = 6 nơ-tron.
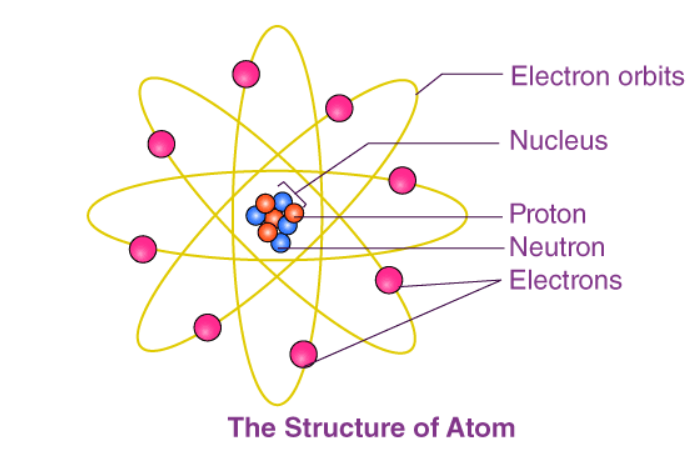
Các vấn đề xoay quanh điện tích hạt nhân
Điện tích
– Điện tích hay còn được hiểu là “vật tích điện”. Mọi vật trung hòa về điện khi cho hay nhận điện tích âm sẽ trở thành điện tích.
Khi vật nhận electron vật sẽ trở thành điện tích âmː
Vật + e → Điện tích âm (-)
Khi vật cho electron vật sẽ trở thành điện tích dươngː
Vật − e → Điện tích dương (+)
Điện tích hạt nhân
Hạt nhân gồm có các hạt nơtron và proton. Nếu hạt nhân có Z proton, thì điện tích của hạt nhân sẽ bằng Z+ và số đơn vị điện tích của hạt nhân bằng Z.
Điện tích của electron và của proton lần lượt là -1,6.10-19 và +1,6.10-19
Nguyên tử trung hòa về điện nên số proton trong hạt nhân bằng với số electron của nguyên tử.
Vậy trong nguyên tử:
Số đơn vị của điện tích của hạt nhân Z = số proton = số electron.
Ví dụ: Số đơn vị điện tích hạt nhân có trong nguyên tử Oxi là 8. Vậy nguyên tử Oxi sẽ có 8 proton và 8 electron.
Số khối
– Số khối có kí hiệu là A là tổng số hạt proton (kí hiệu là Z) và tổng số hạt nơtron có kí hiệu là N của hạt nhân đó: A = Z + N
Ví dụ: Hạt nhân của nguyên tử Natri có 11 proton và 12 nơtron. Vậy số khối của hạt nhân nguyên tử Natri là A = 11+12=23.
Sự nhiễm điện của các vật
Dựa vào hiện tượng hút các vật nhẹ để kiểm tra xem một vật có bị nhiễm điện hay không.
Các hiện tượng nhiễm điện của vật như sau:
– Nhiễm điện do khi cọ xát.
– Nhiễm điện do lúc tiếp xúc
– Nhiễm điện do hưởng ứng.
Ví dụ: Khi cọ xát những vật như thanh nhựa, thanh thuỷ tinh, mảnh poli etilen,… vào lụa hoặc dạ thì những vật đó sẽ có thể hút được những vật nhẹ như mẩu giấy hay các sợi bông vì chúng đã bị nhiễm điện.
Điện tích định luật cu lông
Vào năm 1785, Cu-lông, nhà bác học người Pháp, lần đầu tiên lập được định luật về sự phụ thuộc của lực tương tác giữa những điện tích điểm (gọi tắt là lực điện hay lực Cu-lông) vào khoảng cách giữa chúng.
Nội dung: Lực hút hoặc đẩy giữa hai điện tích điểm có phương trùng với đường thẳng nối hai điện tích điểm đó. Và có độ lớn tỉ lệ thuận với độ lớn của hai điện tích và tỉ lệ nghịch với bình phương khoảng cách giữa chúng.
Biểu thức: F=k. |Q1Q2|/∈r2
Trong đó:
+ F: Lực tương tác (N)
+ r: Là khoảng cách của hai điện tích (m)
+Q1Q2: Là điện tích của hai điện tích
+ ε: Là một hệ số phụ thuộc vào môi trường đặt các điện tích được gọi là hằng số điện môi của môi trường đó. Ta chỉ xét ở trong môi trường đồng tính.
Hằng số điện môi
– Điện môi là một môi trường để cách điện.
– Khi đặt các điện tích điểm trong điện môi (ví dụ như trong một chất dầu cách điện) đồng tính chiếm đầy không gian xung quanh những điện tích. Khi đó, lực tương tác sẽ yếu đi ε lần so với khi đặt chúng trong chân không. ε được gọi là hằng số điện môi trong môi trường (ε ≥ 1). Ở trong chân không thì ε = 1 còn đối với các môi trường khác thì ε >1.
– Hằng số điện môi là một đặc trưng quan trọng cho tính chất điện của một chất dùng để cách điện. Nó cho biết khi đặt điện tích ở trong chất đó thì lực tương tác giữa các điện tích sẽ nhỏ đi bao nhiêu lần so với khi đặt chúng ở trong chân không.
Bài tập vận dụng về điện tích hạt nhân
Bài 1: Nguyên tử A có tổng số hạt là 52, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16. Tính số hạt từng loại.
Bài 2: Nguyên tử B có tổng số hạt là 28. Số hạt không mang điện chiếm 35,7%. Tính số p, n , e.
Bài 3: Nguyên tử Sắt có điện tích hạt nhân là 26+. Trong nguyên tử, số hạt mang điện nhiều hơn số hạt không mang điện là 22. Hãy xác định số khối của nguyên tử Sắt.
Bài 4: Nguyên tử M có số nơtron nhiều hơn số proton là 1 và số hạt mang điện nhiều hơn số hạt không mang điện là 10. Xác định cấu tạo nguyên tử. Đối chiếu bảng các nguyên tố SGK xem M là nguyên tố nào?
Bài 5: Tổng số hạt trong nguyên tử là 28, trong đó số hạt không mang điện chiếm xấp xỉ 35 %. Tính số hạt mỗi loại. Vẽ sơ đồ cấu tạo nguyên tử.
Bài 6: Nguyên tử của một nguyên tố A có tổng số hạt proton, nơtron, electron là 48, trong đó số hạt mang điện gấp hai lần số hạt không mang điện. Tính số hạt mỗi loại.
Bài 7: Nguyên tử X có tổng số proton, nơtron, electron là 116 trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 24. Xác định số hạt từng loại.
Bài 8: Tổng số hạt proton, nơtron, electron trong 2 nguyên tử kim loại A và B là 142 trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 42, số hạt mang điện của B nhiều hơn A là 12. Tính số proton mỗi loại.
Bài 9: Tổng số hạt p, n, e trong 2 nguyên tử kim loại A và B là 177. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 47. Số hạt mang điện của nguyên tử B nhiều hơn của nguyên tử A là 8. Tính số proton mỗi loại.
Bài 10: Nguyên tử Nhôm có điện tích hạt nhân là 13+. Trong nguyên tử nhôm, số hạt mang điện nhiều hơn số hạt không mang điện là 12 hạt. Hãy cho biết số khối của nhôm.
Bài 11: Tổng số hạt proton, nơtron, electron trong 2 nguyên tử kim loại A và B là 142 trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 42, số hạt mang điện của B nhiều hơn A là 12. Tính số proton mỗi loại.
Bài 12: Tổng số hạt cơ bản trong phân tử R2X là 28 hạt. Biết rằng số khối của X lớn hơn số khối của R là 15, trong nguyên tử X số hạt mang điện gấp đôi số hạt không mang điện và nguyên tử R không có nơtron. Số proton trong nguyên tử X là
Bài 13: Cho các nguyên tố X, Y, Z. Tổng số hạt p, n và e trong các nguyên tử lần lượt là 16, 58 và 78. Số notron trong hạt nhân và số hiệu nguyên tử của mỗi nguyên tố khác nhau không quá 1 đơn vị. Hãy xác định các nguyên tố và viết ký hiệu của các nguyên tố.
Bài 14: Hợp chất G có công thức phân tử là M2X. Tổng số các hạt trong M2X là 140, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 44, số khối của M nhiều hơn số khối của X là 23, tổng số hạt của ion M+ nhiều hơn ion X2- là 31. Tìm công thức phân tử của M2X.
Bài 15: Cho hợp chất MX2. Trong phân tử MX2 có tổng số hạt cơ bản là 140 và số hạt mang điện nhiều hơn số hạt không mang điện là 44, Số khối của X lớn hơn số khối của M là 11. Tổng số hạt cơ bản trong X nhiều hơn trong M là 16. Xác định ký hiệu nguyên tử M, X và công thức MX2.
Đáp án – Hướng dẫn giải
Bài 1: Tổng số hạt: p + n + e = 52 Vì p = e => 2p + n = 52 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 16: 2p – n = 16 (2)
Từ (1), (2) giải hệ phương trình: p = e = 17; n = 18
Bài 2:
Nguyên tử B có tổng số hạt là 28: 2p + n = 28
Số hạt không mang điện chiếm 35,7% =>
=> p = e = 9
Bài 3:
Điện tích hạt nhân bằng 26+ => số p = 26
vì nguyên tử trung hòa về điện nên p = e
ta có (p + e) – n = 22 mà p = e => 2p – n = 22
=> 2.26 – n = 22 => 52 – n = 22 => n = 30
Do đó nguyên tử khối của Fe là : 30 + 26 = 56 đvC
Bài 4:
Gọi số hạt nơtron là N, số hạt proton là z.
Có N nhiều hơn z là 1 hạt nên ta có z + 1 = N (1)
Do số hạt e = p = z và số hạt mang điện (z) nhiều hơn số hạt không mang điện (N) là 10 nên ta có 2z – N = 10 (2)
Từ (1) (2) ta có z = 11 và N = 12
Suy ra A = z + N = 11 + 12 = 23 và M là Na.
Bài 5:
Ta có p + n + e= 38
Mà p = e nên 2p + n = 38 (1)
Số hạt ko mang điện là: n = 28.35:100 = 10 (2)
Thay (2) vào (1) có 2p = 38 – n <=> 2p=38-10 <=> p = 14 = e
Sơ đồ tự vẽ
Bài 6:
Theo đề ta có n + e + p = 48
<=> 2p + n = 48 (1)
và có 2p = 2n
<=> n = p (2)
Từ 1 và 2 => 3p = 48 <=> p = n = e = 16
Bài 7:
Ta có
p + n + e = 116 mà p = e <=> 2p + n = 116 (1)
Vì số hạt mang điện nhiều hơn số hạt không mang điện là 24
=> (p + e) – n = 24 mà p = e <=> 2p – n = 24 (2)
Từ (1) (2) => giải hệ bấm máy tính
=> p = 35, n = 46
Vì p=35=>nguyên tử X là Brom
Bài 8:
Có: 2Z(A) + 2Z(B) + (NA + NB) = 142(1)
2(Z(A) + Z(B)) – (N(A) + N(B)) = 42 (2)
=> Z(B) – Z(A)=6 (3)
=>Z(A) + (B) = 46; N(A) + N(B) = 50
=> Z(A) = 26 và Z(B) = 20
=> Là Fe và Ca.
Bài 9:
Đặt số proton, notron của A lần lượt là pA, nA
Đặt số proton, notron của A lần lượt là pB, nB
Nguyên tử trung hòa về điện nên số proton = số notron → eA = pA ; eB = pB
Tổng số hạt p,n,e trong 2 nguyên tử A, B là 142 nên ta có phương trình:
(pA + eA + nA) + (pB + eB + nB) = 177
→ 2pA + nA + 2pB + nB = 177
→ 2pA + 2pB + nA + nB = 177 (1)
Trong A, B số hạt mang điện nhiều hơn số hạt không mang điện là 47 nên ta có phương trình
(pA + eA + pB + eB) – (nA + nB) = 47
→ (2pA + 2pB) – (nA + nB) = 47 (2)
Số hạt mang điện của B nhiều hơn A là 8 nên ta có phương trình
(pB + eB) – (pA + eA) = 8
→ 2pB – 2pA = 8
→ pB – pA = 4 (3)
Từ (1) và (2) ta có hệ phương trình:
Từ (3) và (4) kết hợp ta có hệ phương trình:
Bài 10:
Ta có điện tích hạt nhân là 13+ , tức p = 13 (1)
Ta lại có (p + e) – n = 12
Mà p = e Suy ra 2 p – n = 12 (2)
Thế (1) vào (2) ta được: 2 . 13 – n = 12
Suy ra n = 26 – 12 = 14
Số khối A = p + n = 13 + 14 = 27. Vậy số khối của nhôm là 27.
Bài 11:
Đặt số proton, notron của A lần lượt là pA, nA
Đặt số proton, notron của B lần lượt là pB, nB
Ta có số proton = số electron (vì nguyên tử trung hòa về điện)
→ eA = pA; eB = pB
Tổng số hạt p, n, e trong 2 nguyên tử A, B là 142 nên ta có phương trình:
(pA + eA + nA) + (pB+ eB + nB) = 142
→ 2pA + nA + 2pB + nB = 142
→ 2pA + 2pB + nA + nB = 142 (1)
Trong A, B số hạt mang điện nhiều hơn số hạt không mang điện là 42 nên ta có phương trình
(pA + eA + pB + eB) – (nA + nB) = 42
→ (2pA + 2pB) – (nA + nB) = 42 (2)
Số hạt mang điện của B nhiều hơn A là 12 nên ta có phương trình
(pB + eB) – (pA + eA) = 12
→ 2pB – 2pA = 12
→ pB – pA = 6 (3)
Từ (1) và (2) ta có hệ phương trình:
Từ (3), (4) kết hợp ta có hệ phương trình:
Bài 12:
Gọi các hạt cơ bản trong R là: pR, eR, nR ; các hạt trong X là pX, eX, nX
Tổng số các hạt cơ bản trong R2X là 28 hạt
=> 2.(pR + eR + nR) + pX+ eX + nX= 28
=> 2.(2.pR + nR) + 2.pX + nX = 28
=> 4.pR + 2.pX+ 2.nR + nX= 28 (1)
Số khối của X lớn hơn số khối của R là 15 => AX – AR = 15
=> pX + nX – (pR + nR) = 15 (2)
Trong nguyên tử X số hạt mang điện gấp đôi số hạt không mang điện
=> pX + eX = 2.nX (3)
Nguyên tử R không có nơtron => nR = 0 (4)
Từ (1); (2), (3), (4) ta có hệ phương trình
Bài 13:
Cho các nguyên tố X, Y, Z. Tổng số hạt p, n và e trong các nguyên tử lần lượt là 16, 58 và 78. Số notron trong hạt nhân và số hiệu nguyên tử của mỗi nguyên tố khác nhau không quá 1 đơn vị. Hãy xác định các nguyên tố và viết ký hiệu của các nguyên tố.
+) Với nguyên tử nguyên tố có tổng số hạt là 16
Ta có: 2Z1 + N1 = 16
Mà ta luôn có: 1 ≤ N1 / Z1 ≤ 1,5
⇔Z1 ≤ N1≤ 1,5Z1⇔ 3 Z1 ≤ 2 Z1 + N1≤ 3,5 Z1
⇔ 4,57 ≤ Z1 ≤ 5,33
Vậy Z1 = 5⇒ N1 = 6 ⇒ A1 = 11
+) Với nguyên tử nguyên tố có tổng số hạt là 58
Ta có: 2Z2 + N2 = 58
Mà ta luôn có: 1 ≤ N2/ Z2 ≤ 1,5
⇔ Z2 ≤ N2 ≤ 1,5Z2 ⇔ 3Z2≤ 2Z2+ N2 ≤ 3,5Z2 ⇔ 16,57 ≤ Z2 ≤ 19,3
Mặt khác ta có
N2 − Z2 ≤1 ⇔ 58 − 3Z2 ≤ 1
⇔ Z2 ≥ 19
Vậy Z2= 19 ⇒ N2 = 20 ⇒ A2 = 39
+) Với nguyên tử nguyên tố có tổng số hạt là 78
Ta có: 2Z3 + N3 = 78
Mà ta luôn có: 1 ≤ N3/Z3 ≤ 1,5
⇔ Z3 ≤ N3≤ 1,5Z3⇔ 3Z3 ≤ 2Z3 + N3 ≤ 3,5Z3⇔ 22,3 ≤ Z2 ≤ 26
Mặt khác ta có:
N3 −Z3 ≤ 1⇔ 78 − 3Z3 ≤ 1
⇔ Z3 ≥ 25,66
Vậy Z3 = 26 ⇒ N2= 26 ⇒ A2 = 52
Bài 14:
Trong M2X : 2p + n = 140 (1) ; 2p – n = 44 (2)
Giải hệ phương trình (1), (2)
=>p = 46 ; n = 48
=> AM2X = 94 = 2AM + AX (3)
Mà AM – AX = 23 (4)
Giải hệ phương trình (3) và (4)
=>AM = pM + nM =39 ; AX = pX+ nX =16
Mà (2pM + nM) – (2pX+ nX) = 34
=> 39+ pM – 16 -pX = 34
=>pM – pX = 11
Lại có : pM2X= 2pM + pX = 46
=> pM = 19 (K) và pX = 8 (O)
Vậy M2X là K2O
Bài 15:
Tổng số các hạt trong phân tử là 140
→ 2Z M + N M + 2.(2Z X + N X ) = 140 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 44 hạt
→ 2Z M + 4Z X – N M – 2.N X = 44 (2)
Giải hệ (1), (2) → 2Z M + 4Z X = 92 và N M + 2N X = 48
Tổng số hạt cơ bản trong X nhiều hơn trong M là 16 hạt
→ 2Z X + N X – (2Z M + N M ) = 16 (3)
Số khối của X lớn hơn số khối của M là 11
→ (Z X + N X )- (Z M + N M ) = 11 (4)
Lấy (3) – (4) → Z X – Z M = 5
Ta có hệ:
2ZM + 4ZX = 92
−ZM + ZX=5
⇒ ZM= 12; ZX = 17
M là Mg và X là Cl
Vậy công thức của MX2 là MgCl2.
***
Trên đây là nội dung bài học Điện tích hạt nhân là gì? Cách tính điện tích hạt nhân do thầy cô trường THCS Bình Chánh biên soạn và tổng hợp. Hy vọng sẽ giúp các em hiểu rõ nội dung bài học và từ đó hoàn thành tốt bài tập của mình. Đồng thời luôn đạt điểm cao trong các bài thi bài kiểm tra sắp tới. Chúc các em học tập thật tốt.
Đăng bởi THCS Bình Chánh trong chuyên mục Học tập
- Cảm nhận của anh (chị) về vùng đất và con người miền cực nam của Tổ quốc qua truyện ngắn Bắt sấu rừng U Minh Hạ lớp 12 (9 Mẫu)
- Anh (chị) hãy bày tỏ quan điểm của mình về ý kiến của nhà văn Pháp La Bơ-ruy-e: “Khi một tác phẩm nâng cao tinh thần ta lên và gợi cho ta những tình cảm cao quý và can đảm, không cần tìm một nguyên tắc nào để đánh giá nó nữa: đó là một cuốn sách hay và do một nghệ sĩ viết ra” lớp 12 (10 Mẫu)
- Buy-phông, nhà văn Pháp nổi tiếng, có viết: “Phong cách chính là người”. Anh (chị) hiểu ý kiến trên như thế nào? lớp 12 (12 Mẫu)
- Một trong những bức thư luận bàn về văn chương, Nguyễn Văn Siêu có viết: “Văn chương […] có loại đáng thờ, có loại không đáng thờ. Loại không đáng thờ là loại chỉ chuyên chú ở văn chương. Loại đáng thờ là loại chuyên chú ở con người. Anh chị hãy phát biểu ý kiến của mình về quan niệm trên lớp 12 (7 Mẫu)
- Viết bài văn trong đó vận dụng tổng hợp ít nhất ba thao tác lập luận, theo chủ đề: một tác phẩm văn học mới ra đời và đáng được nhiều người quan tâm bàn luận lớp 12
- Viết bài văn nghị luận trong đó vận dụng tổng hợp ít nhất ba thao tác lập luận khác nhau lớp 12 (3 Mẫu)









