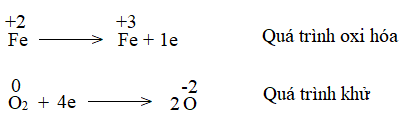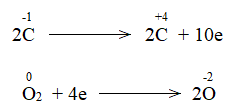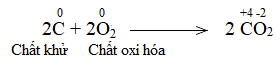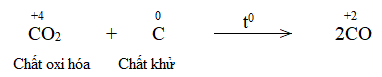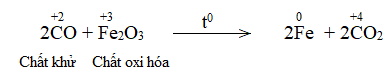Giải Hóa 10 Bài 15 trang 71, 72, 73, 74, 75, 76, 77 Kết nối tri thức
Mời các em theo dõi nội dung bài học hôm nay Giải hóa 10 bài 15 trang 71, 72, 73, 74, 75, 76, 77 Kết nối tri thức
Trong lò luyện gang, xảy ra phản ứng oxi hóa – khử theo sơ đồ:
Xác định số oxi hóa của nguyên tử Fe và S trong các chất sau:
a) Fe, FeO, Fe2O3, Fe(OH)3, Fe3O4.
b) S, H2S, SO2, SO3, H2SO4, Na2SO3.
Bạn đang xem: Giải Hóa 10 Bài 15 trang 71, 72, 73, 74, 75, 76, 77 Kết nối tri thức
CH tr 71 MĐ
|
Trong lò luyện gang, xảy ra phản ứng oxi hóa – khử theo sơ đồ: Fe2O3 + CO \(\xrightarrow{{{t^o}C}}\) Fe + CO2 Về bản chất, phản ứng oxi hóa – khử là gì, dựa vào dấu hiệu nào để nhận ra loại phản ứng đó? Làm thế nào để lập phương trình hóa học của phản ứng trên? |
Hướng dẫn giải:
– Phản ứng oxi hóa – khử xảy ra đồng thời quá trình nhường và nhận.
– Trong phản ứng oxi hóa khử, có sự thay đổi số oxi hóa.
– Nguyên tắc lập phương trình hóa học của phản ứng oxi hóa – khử là tổng số electron nhường bằng tổng số electron nhận.
Lời giải:
– Về bản chất, phản ứng oxi hóa – khử là phản ứng xảy ra đồng thời quá trình nhường và quá trình nhận electron.
– Dấu hiệu để nhận ra loại phản ứng oxi hóa – khử là có sự thay đổi số oxi của các nguyên tử.
– Các bước lập phương trình hóa học của phản ứng oxi hóa – khử:
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa, chất khử
Nguyên tử Fe và C có sự thay đổi số oxi hóa, Fe là chất oxi hóa, C là chất khử
Bước 2: Biểu diễn quá trình oxi hóa, quá trình khử
Fe+3 + 3e → Fe0
C+2 → C+4 + 2e
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc tổng electron nhường bằng tổng electron nhận.
2x /Fe+3 + 3e → Fe0
3x /C+2 → C+4 + 2e
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng.
Fe2O3+ 3CO \(\xrightarrow{{{t^o}C}}\) 2Fe + 3CO2
CH tr 73 CH
|
1. Xác định số oxi hóa của nguyên tử Fe và S trong các chất sau: a) Fe, FeO, Fe2O3, Fe(OH)3, Fe3O4. b) S, H2S, SO2, SO3, H2SO4, Na2SO3. |
Hướng dẫn giải:
Quy tắc xác định số oxi hóa:
– Trong đơn chất, số oxi hóa của nguyên tử bằng 0.
– Trong hợp chất, thông thường số oxi hóa của hydrogen là +1, của oxygen là -2, các kim loại điển hình có số oxi hóa dương bằng số electron hóa trị.
– Trong hợp chất, tổng số oxi hóa của các nguyên tử trong phân tử bằng 0.
– Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích ion; trong ion đa nguyên tử, tổng số oxi hóa của các nguyên tử bằng điện tích ion.
Lời giải:
CH tr 73 HĐ
|
Xác định chất oxi hóa, chất khử Chuẩn bị: đinh sắt, dung dịch CuSO4, dung dịch H2SO4 loãng, ống nghiệm. Thực hiện: Thí nghiệm 1: Cho đinh sắt vào ống nghiệm đựng dung dịch CuSO4. Thí nghiệm 2: Cho đinh sắt vào ống nghiệm đựng dung dịch H2SO4. Quan sát hiện tượng và trả lời câu hỏi: 1. Viết quá trình oxi hóa, quá trình khử. 2. Xác định chất oxi hóa, chất khử trong hai phản ứng trên. |
Hướng dẫn giải:
– Chất khử là chất nhường electron
– Chất oxi hóa là chất nhận electron
Lời giải:
1.
* Thí nghiệm 1: Fe + CuSO4 → FeSO4 + Cu
Quá trình oxi hóa: Fe0 → Fe+2 + 2e
Quá trình khử: Cu+2 + 2e → Cu0
* Thí nghiệm 2: Fe + H2SO4 → FeSO4 + H2
Quá trình oxi hóa: Fe0 → Fe+2 + 2e
Quá trình khử: 2H+ + 2e → H20
2.
* Thí nghiệm 1:
– Chất oxi hóa CuSO4
– Chất khử Fe
* Thí nghiệm 2:
– Chất oxi hóa H2SO4
– Chất khử Fe
CH tr 74 CH
|
2. Trong không khí ẩm, Fe(OH)2 màu trắng xanh chuyển dần sang Fe(OH)3 màu nâu đỏ: Fe(OH)2 + O2 + H2O → Fe(OH)3 a) Hãy xác định các nguyên tử có sự thay đổi số oxi hóa. b) Viết quá trình oxi hóa, quá trình khử. c) Dùng mũi tên biểu diễn sự chuyển electron từ chất khử sang chất oxi hóa |
Hướng dẫn giải:
– Quá trình oxi hóa là quá trình chất khử nhường electron, quá trình khử là quá trình chất oxi hóa nhận electron.
– Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron.
Lời giải:
a)
– Trong Fe(OH)2, iron có số oxi hóa +2
– Trong Fe(OH)3, iron có số oxi hóa +3
=> Nguyên tử iron có sự thay đổi số oxi hóa từ +2 lên +3.
– Trong O2, oxygen có số oxi hóa 0
– Trong Fe(OH)3, oxygen có số oxi hóa -2
=> Nguyên tử oxygen có sự thay đổi số oxi hóa từ 0 xuống -2.
b)
c)
1 phân tử Fe(OH)2 nhường 1 electron => 4 phân tử Fe(OH)2 nhường 4 electron
CH tr 75 CH
|
3. Xét các phản ứng hóa học xảy ra trong công nghiệp: Phản ứng nào là phản ứng oxi hóa – khử? Lập phương trình hóa học của phản ứng oxi hóa khử theo phương pháp thăng bằng electron. |
Hướng dẫn giải:
Dấu hiệu để nhận biết phản ứng oxi hóa – khử là có sự thay đổi số oxi hóa của các nguyên tử.
Lời giải:
a)
Trước phản ứng, các nguyên tử Al, O và H có số oxi hóa lần lượt là +3, -2, +1
Sau phản ứng, các nguyên tử Al, O và H có số oxi hóa lần lượt là +3, -2, +1.
=> Trong phản ứng, các nguyên tử không có sự thay đổi số oxi hóa => Không là phản ứng oxi hóa – khử.
b)
Trong phản ứng, C trước phản ứng có số oxi hóa 0. Kết thúc phản ứng, C có số oxi hóa +2
=> Phản ứng oxi hóa khử
Bước 1: Xác định số oxi hóa của nguyên tử bị thay đổi:
Bước 2: Biểu diễn quá trình oxi hóa – khử:

Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa theo nguyên tắc: tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.

Bước 4: Đặt hệ số
C + CO2 \(\xrightarrow{{{t^o}}}\) 2CO
CH tr 76 CH
|
4. Nêu một số phản ứng oxi hóa – khử có lợi và có hại trong thực tế. |
Hướng dẫn giải:
– Sự cháy là phản ứng oxi hóa – khử xảy ra ở nhiệt độ cao giữa chất cháy và chất oxi hóa.
– Phần lớn các phản ứng hóa học xảy ra trong các quy trình sản xuất là phản ứng oxi hóa – khử.
– Sự han gỉ các đồ vật, thiết bị làm bằng kim loại do sự oxi hóa của oxygen.
Lời giải:
Phản ứng oxi hóa – khử có lợi: sự cháy,…
Phản ứng oxi hóa – khử có hại: sự han gỉ các thiết bị, đồ dùng được làm bằng sắt,…
CH tr 76 CH
|
5. Lập phương trình hóa học của các phản ứng trong quá trình sản xuất sulfuric acid theo sơ đồ mục IV.3. Trong các phản ứng đó, phản ứng nào là phản ứng oxi hóa – khử? |
Hướng dẫn giải:
Dấu hiệu để nhận biết phản ứng oxi hóa – khử là có sự thay đổi số oxi hóa của các nguyên tử.
Lời giải:
CH tr 76 CH
|
6. Đèn xì ogygen – acetylene có cấu tạo gồm hai ống dẫn khí: một ống dẫn khí oxygen, một ống dẫn khí acetylene (Hình 15.1). Khi đèn hoạt động, hai khí này được trộn vào nhau để thực hiện phản ứng đốt cháy theo sơ đồ: C2H2 + O2 \(\xrightarrow{{{t^o}}}\) CO2 + H2O Phản ứng tỏa nhiệt lớn, tạo ra ngọn lửa có nhiệt độ đạt đến 30000C nên được dùng để hàn cắt kim loại. Hãy xác định chất oxi hóa, chất khử và lập phương trình hóa học của phản ứng trên theo phương pháp thăng bằng electron. |
Hướng dẫn giải:
Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron.
Lời giải:
Bước 1:
Bước 2:
Bước 3:
Bước 4:
2C2H2 + 5O2 \(\xrightarrow{{{t^o}}}\) 4CO2 + 2H2O
CH tr 77 CH
|
7. Trong quá trình luyện gang từ quặng chứa Fe2O3, ban đầu không khí nóng được nén vào lò cao, đốt cháy hoàn toàn than cốc kèm theo tỏa nhiệt mạnh: C + O2 \(\xrightarrow{{{t^o}}}\) CO2 Khí CO2 đi lên phía trên, gặp các lớp than cốc và bị khử thành CO: CO2 + C \(\xrightarrow{{{t^o}}}\) CO Tiếp đó, khí CO khử Fe2O3 theo phản ứng tổng quát: Fe2O3 + CO \(\xrightarrow{{{t^o}}}\) Fe + CO2 Lập các phương trình hóa học ở trên, chỉ rõ chất oxi hóa, chất khử |
Hướng dẫn giải:
Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron.
Lời giải:
Lý thuyết
Hướng dẫn giải:
Lời giải:
>> Xem chi tiết: Lý thuyết bài 15: Phản ứng oxi hóa – khử
Hy vọng với nội dung trong bài Giải hóa 10 bài 15 trang 71, 72, 73, 74, 75, 76, 77 Kết nối tri thức
do thầy cô trường Trung học Bình Chánh biên soạn sẽ giúp các em nắm chắc kiến thức nội dung bài học tốt hơn để từ đó hoàn thành tất cả các bài tập trong SGK.
Đăng bởi: THCS Bình Chánh
Chuyên mục: Hóa học 10 Kết nối tri thức
- Giải Hóa 10 Bài 1 trang 13, 14, 15, 16 Kết nối tri thức
- Giải Hóa 10 Bài 2 trang 17, 18, 19, 20 Kết nối tri thức
- Giải Hóa 10 Bài 3 trang 21, 22, 23, 24, 25 Kết nối tri thức
- Giải Hóa 10 Bài 4 trang 26, 27 Kết nối tri thức
- Giải Hóa 10 Bài 5 trang 30, 31, 32, 33 Kết nối tri thức
- Giải Hóa 10 Bài 6 trang 34, 35, 36, 37, 38, 39 Kết nối tri thức