Giải Hóa 10 Bài 13 trang 70, 71, 72, 73, 74, 75, 76 Cánh diều
Mời các em theo dõi nội dung bài học hôm nay Giải hóa 10 bài 13 trang 70, 71, 72, 73, 74, 75, 76 Cánh diều
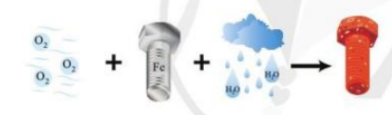
Quá trình bị gỉ của đinh ốc ngoài không khí được mô tả như hình dưới đây:
Xác định số oxi hóa của mỗi nguyên tử nguyên tố trong các hợp chất ion Al2O3, CaF2.
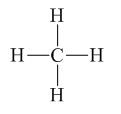
Xác định số oxi hóa của mỗi nguyên tử trong hợp chất sau: N = O, CH4.
Bạn đang xem: Giải Hóa 10 Bài 13 trang 70, 71, 72, 73, 74, 75, 76 Cánh diều
CH tr 70 MĐ
|
Quá trình bị gỉ của đinh ốc ngoài không khí được mô tả như hình dưới đây: Trong quá trình này, hãy cho biết nguyên tử nguyên tố nào nhường electron, nguyên tố nào nhận electron. Giải thích. |
Hướng dẫn giải:
– Viết PT.
– Xác định số oxi hóa của những nguyên tố có số oxi hóa thay đổi.
– Viết quá trình nhường electron, nhận electron.
Lời giải:
PT: 3O2 + 4Fe + 6H2O → 4Fe(OH)3↓
Fe → Fe3+ + 3e (nhường electron).
O2 + 4e → 2O2- (nhận electron).
CH tr 71 LT
|
1. Xác định số oxi hóa của mỗi nguyên tử nguyên tố trong các hợp chất ion Al2O3, CaF2. 2. Xác định số oxi hóa của mỗi nguyên tử trong hợp chất sau: N = O, CH4. |
Hướng dẫn giải:
– Số oxi hóa của một nguyên tử một nguyên tố trong hợp chất là điện tích của nguyên tử nguyên tố đó.
– Cách xác định số oxi hóa
+ Cách 1: Dựa theo số oxi hóa của một số nguyên tử đã biết.
Quy tắc 1. Trong các hợp chất: Số oxi hóa của H là +1 (trừ NaH, CaH2, …); Số oxi hóa của O là -2 (trừ OF2, H2O2, …); Số oxi hóa của các kim loại kiềm (nhóm IA: Li, Na, K, ..,) là +1, kim loại kiềm thổ (nhóm IIA: Be, Mg, Ca, Ba, …) là +2, số oxi hóa của Al là +3.
Quy tắc 2. Tổng các số oxi hóa của các nguyên tử trong phân tử bằng 0, của một ion đa nguyên tử bằng chính điện tích của ion đó.
+ Cách 2: Dựa theo công thức cấu tạo.
Cách tính điện tích các nguyên tử trong hợp chất với giả định đó là hợp chất ion dựa vào công thức cấu tạo.
Lời giải:
1.
– Al2O3: Số oxi hóa của O là -2.
Gọi a là số oxi hóa của Al. Áp dụng quy tắc 1 và 2
=> a.2 + (-2).3 = 0 → x = +3
Vậy số oxi hóa của O là -2, Al là +3
– CaF2
Gọi x là số oxi hóa của F, theo quy tắc 1 và 2 có:
1.(+2) + 2.x = 0 → x = -1.
Vậy số oxi hóa của Ca là +2, của F là -1.
2.
– N = O có công thức ion giả định là N2+O2-
Vậy số oxi hóa của N là +2, O là -2.
– CH4 có công thức ion giả định là C4-H4+
Vậy số oxi hóa của C là -4, H là +1.
CH tr 71 CH
| 1. Dựa theo quy tắc octet, giải thích vì sao số oxi hóa của O là -2, của kim loại nhóm IA là +1, của kim loại nhóm IIA là +2 và của Al là +3. |
Hướng dẫn giải:
Quy tắc octet: trong phản ứng hóa học, các nguyên tử có xu hướng hình thành lớp vỏ bền vững như của khí hiếm.
Lời giải:
– Nguyên tử O với cấu hình electron là 1s22s22p4, có 6 electron ở lớp vỏ ngoài cùng nên xu hướng cơ bản là nhận thêm 2 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài như khí hiếm ⇒ Vậy số oxi hóa của O là -2.
O + 2e → O2-
– Nguyên tử kim loại nhóm IA có cấu hình electron chung là ns1, có 1 electron ở lớp vỏ ngoài cùng nên xu hướng cơ bản là nhường đi 1 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài như khí hiếm ⇒ Vậy số oxi hóa của kim loại nhóm IA là +1.
– Nguyên tử kim loại nhóm IIA có cấu hình electron chung là ns2, có 2 electron ở lớp vỏ ngoài cùng nên xu hướng cơ bản là nhường đi 2 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài như khí hiếm ⇒ Vậy số oxi hóa của kim loại nhóm IIA là +2.
– Nguyên tử Al với cấu hình electron là [Ne]3s23p1, có 3 electron ở lớp vỏ ngoài cùng nên xu hướng cơ bản là nhường đi 3 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài như khí hiếm ⇒ Vậy số oxi hóa của Al là +3.
Al → Al3+ + 3e
CH tr 72 LT
|
3. Xác định số oxi hóa của mỗi nguyên tử trong của hợp chất: Fe2O3, Na2CO3, KAl(SO4)2. |
Hướng dẫn giải:
– Cách xác định số oxi hóa
+ Quy tắc 1. Trong các hợp chất: Số oxi hóa của H là +1 (trừ NaH, CaH2, …); Số oxi hóa của O là -2 (trừ OF2, H2O2, …); Số oxi hóa của các kim loại kiềm (nhóm IA: Li, Na, K, ..,) là +1, kim loại kiềm thổ (nhóm IIA: Be, Mg, Ca, Ba, …) là +2, số oxi hóa của Al là +3.
+ Quy tắc 2. Tổng các số oxi hóa của các nguyên tử trong phân tử bằng 0, của một ion đa nguyên tử bằng chính điện tích của ion đó.
Lời giải:
– Fe2O3
Gọi x là số oxi hóa của Fe, theo quy tắc 1 và 2 có:
2.x + 3.(-2) = 0 → x = +3.
Vậy số oxi hóa của Fe là +3, của O là -2.
– Na2CO3
Gọi x là số oxi hóa của C, theo quy tắc 1 và 2 có:
2.(+1) + 1.x + 3.(-2) = 0 → x = +4.
Vậy số oxi hóa của Na là +1, của C là +4, của O là -2.
– KAl(SO4)2
Gọi x là số oxi hóa của S, theo quy tắc 1 và 2 có:
1.(+1) + 1.(+3) + 2[1.x + 4.(-2)] = 0 → x = +6.
Vậy số oxi hóa của K là +1, của Al là +3, của S là +6, của O là -2.
CH tr 72 LT
|
4. Xác định số oxi hóa của mỗi nguyên tử trong các ion: NO3–, NH4+, MnO4–. |
Hướng dẫn giải:
– Cách xác định số oxi hóa
+ Quy tắc 1. Trong các hợp chất: Số oxi hóa của H là +1 (trừ NaH, CaH2, …); Số oxi hóa của O là -2 (trừ OF2, H2O2, …); Số oxi hóa của các kim loại kiềm (nhóm IA: Li, Na, K, ..,) là +1, kim loại kiềm thổ (nhóm IIA: Be, Mg, Ca, Ba, …) là +2, số oxi hóa của Al là +3.
+ Quy tắc 2. Tổng các số oxi hóa của các nguyên tử trong phân tử bằng 0, của một ion đa nguyên tử bằng chính điện tích của ion đó.
Lời giải:
– NO3–
Gọi x là số oxi hóa của N, theo quy tắc 1 và 2 có:
1.x + 3.(-2) = -1 → x = +5.
Vậy số oxi hóa của N là +5, của O là -2.
– NH4+
Gọi x là số oxi hóa của N, theo quy tắc 1 và 2 có:
1.x + 4.(+1) = +1 → x = -3.
Vậy số oxi hóa của N là -3, của H là +1.
– MnO4–
Gọi x là số oxi hóa của Mn, theo quy tắc 1 và 2 có:
1.x + 4.(-2) = -1 → x = +7.
Vậy số oxi hóa của Mn là +7, của O là -2
CH tr 72 LT
|
5. Xác định số oxi hóa của mỗi nguyên tố trong NH3 theo cách 2. |
Hướng dẫn giải:
– Viết công thức cấu tạo của NH3 theo công thức Lewis.
– Cách tính điện tích các nguyên tử trong hợp chất với giả định đó là hợp chất ion dựa vào công thức cấu tạo.
Lời giải:
Bước 1: Viết cấu hình electron của N (Z = 7) và H (Z = 1)
N (Z = 7): 1s22s22p3
H (Z = 1): 1s1
Bước 2: Biểu diễn sự hình thành các cặp electron chung cho NH3
H có 1e ở lớp electron ngoài cùng, N có 5e ở lớp electron ngoài cùng.
⟹ Mỗi nguyên tử góp chung 1e để đạt cấu hình khí hiếm bền vững.
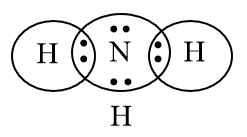
Bước 3: Công thức Lewis của NH3

NH3 có công thức ion giả định là N3-H3+
Vậy số oxi hóa của N là -3, của H là +1.
CH tr 72 CH
| 2. Dựa vào độ âm điện, giải thích vì sao công thức ion giả định của OF2 là F–O2+F– mà không phải là F+O2-F+. |
Hướng dẫn giải:
Trong liên kết giữa nguyên tử A và B, nếu độ âm điện của nguyên tử A nào nhỏ độ âm điện của nguyên tử B thì nguyên tử B mang phần điện tích âm, nguyên tử A mang điện tích dương.
Lời giải:
Độ âm điện của F (3,98) lớn hơn O (3,44) nên nguyên tử F mang phần điện tích âm còn nguyên tử O mang phần điện tích dương.
CH tr 73 CH
|
3. Xác định số oxi hóa của các nguyên tử trong phản ứng (1), (2). Cho biết nguyên tố nào có sự thay đổi số oxi hóa. 4. Nguyên tố Cl thể hiện bao nhiêu số oxi hóa trong phản ứng (3)? |
Hướng dẫn giải:
– Cách xác định số oxi hóa
+ Quy tắc 1. Trong các hợp chất: Số oxi hóa của H là +1 (trừ NaH, CaH2, …); Số oxi hóa của O là -2 (trừ OF2, H2O2, …); Số oxi hóa của các kim loại kiềm (nhóm IA: Li, Na, K, ..,) là +1, kim loại kiềm thổ (nhóm IIA: Be, Mg, Ca, Ba, …) là +2, số oxi hóa của Al là +3.
+ Quy tắc 2. Tổng các số oxi hóa của các nguyên tử trong phân tử bằng 0, của một ion đa nguyên tử bằng chính điện tích của ion đó.
Chú ý: Số oxi hóa của đơn chất bằng 0.
Lời giải:
1.
(1) 2Ag0 + Cl20 → 2Ag+Cl–
Nguyên tố Ag và Cl thay đổi số oxi hóa.
(2) 2Ag+N5+O32- + Ba2+Cl2– → 2Ag+Cl– + Ba2+(N5+O32-)2
Không có nguyên tố nào thay đổi số oxi hóa.
2.
(3) Cl20 + 2NaOH → Na+O2-Cl+ + Na+Cl– + H2O
Nguyên tố Cl thể hiện 3 số oxi hóa trong phản ứng (3).
CH tr 74 CH
|
5. Trong phản ứng ở ví dụ 1, hãy chỉ ra chất khử, chất oxi hóa, quá trình khử, quá trình oxi hóa. |
Hướng dẫn giải:
– Chất khử (chất bị oxi hóa) là chất nhường electron.
Na → Na+ + 1e (quá trình oxi hóa)
– Chất oxi hóa (chất bị khử) là chất nhận electron.
Cl + 1e → Cl– (quá trình khử)
Lời giải:
Al + O2 → Al2O3
Al0 → Al3+ + 3e (quá trình oxi hóa)
Al là chất nhường electron → chất khử.
O0 + 2e → O2- (quá trình khử)
O là chất nhận electron → chất oxi hóa.
CH tr 74 CH
|
6. Cân bằng các phản ứng oxi hóa – khử sau. Chỉ ra chất oxi hóa, chất khử, sự oxi hóa, sự khử. Fe2O3 + CO → Fe + CO2 NH3 + O2 → NO + H2O 7. Các phản ứng trên thường gặp trong cuộc sống và sản xuất. Những phản ứng này thường diễn ra trong quá trình nào? |
Hướng dẫn giải:
Bước 1. Xác định và ghi sự thay đổi số oxi hóa trước và sau phản ứng.
Al0 + O20 → Al23+O32-
Bước 2. Viết các quá trình oxi hóa và quá trình khử.
Al0 → Al3+ + 3e
O0 + 2e → O2-
Bước 3. Thăng bằng electron bằng cách nhân thêm hệ số vào các bán phản ứng nhường và nhận electron sao cho tổng số electron nhường bằng tổng số electron nhận. Cộng các bán phản ứng (đã nhân hệ số) với nhau sẽ thu được sơ đồ.
|
2 x 3 x |
Al0 → Al3+ + 3e O0 + 2e → O2- |
⇒ 2Al0 + 3O0 → 2Al3+ + 3O2-
Bước 4. Dựa vào sơ đồ để hoàn thành phương trình dạng phân tử.
4Al + 3O2 → 2Al2O3
Lời giải:
6.
a) Fe2O3 + CO → Fe + CO2
Bước 1. Xác định và ghi sự thay đổi số oxi hóa trước và sau phản ứng.
Fe23+O32- + C2+O2- → Fe0 + C4+O22-
Bước 2. Viết các quá trình oxi hóa và quá trình khử.
Fe3+ + 3e → Fe
C2+ → C4+ + 2e
Bước 3.
|
2 x 3 x |
Fe3+ + 3e → Fe C2+ → C4+ + 2e |
⇒ 2Fe3+ + 3C2+ → 2Fe + 3C4+
Bước 4. Dựa vào sơ đồ để hoàn thành phương trình dạng phân tử.
Fe2O3 + 3CO → 2Fe + 3CO2
b) NH3 + O2 → NO + H2O
Bước 1. Xác định và ghi sự thay đổi số oxi hóa trước và sau phản ứng.
N3-H3+ + O20 → N2+O2- + H2+O2-
Bước 2. Viết các quá trình oxi hóa và quá trình khử.
O20 + 4e → O2-
N3- → N2+ + 5e
Bước 3.
|
5 x 4 x |
O20 + 4e → 2O2- N3- → N2+ + 5e |
⇒ 4N3- + 5O20 → 4N2+O2- + 6O2-
Bước 4. Dựa vào sơ đồ để hoàn thành phương trình dạng phân tử.
4NH3 + 5O2 → 4NO + 6H2O
7. Các phản ứng trên thường gặp trong cuộc sống và sản xuất. Những phản ứng này thường diễn ra trong quá trình sản xuất gang và sản xuất acid nitric.
CH tr 74 LT
| 6. Cân bằng các phản ứng oxi hóa – khử sau:
a) HCl + PbO2 → PbCl2 + Cl2 + H2O b) KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O |
Hướng dẫn giải:
Bước 1. Xác định và ghi sự thay đổi số oxi hóa trước và sau phản ứng.
Al0 + O20 → Al23+O32-
Bước 2. Viết các quá trình oxi hóa và quá trình khử.
Al0 → Al3+ + 3e
O0 + 2e → O2-
Bước 3. Thăng bằng electron bằng cách nhân thêm hệ số vào các bán phản ứng nhường và nhận electron sao cho tổng số electron nhường bằng tổng số electron nhận. Cộng các bán phản ứng (đã nhân hệ số) với nhau sẽ thu được sơ đồ.
|
2 x 3 x |
Al0 → Al3+ + 3e O0 + 2e → O2- |
⇒ 2Al0 + 3O0 → 2Al3+ + 3O2-
Bước 4. Dựa vào sơ đồ để hoàn thành phương trình dạng phân tử.
4Al + 3O2 → 2Al2O3
Lời giải:
a) HCl + PbO2 → PbCl2 + Cl2 + H2O
H+Cl– + Pb4+O22- → Pb2+Cl2– + Cl20 + H2+O2-
|
1 x 1 x |
2Cl– → Cl20 + 2e Pb4+ + 2e → Pb2+ |
⇒ 2Cl– + Pb4+ → Pb2+ + Cl20
2HCl + PbO2 → PbCl2 + Cl2 + H2O
b) KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
K+Mn7+O42- + H+Cl– → K+Cl– + Mn2+Cl2– + Cl20 + H2+O2-
|
5 x 2 x |
2Cl– → Cl20 + 2e Mn7+ + 5e → Mn2+ |
⇒ 10Cl– + 2Mn7+ → 2Mn2+ + 5Cl20
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
CH tr 75 VD
| Sắt bị gỉ trong không khí ẩm. Đó có phải là phản ứng oxi hóa – khử không? Đề xuất một vài biện pháp hạn chế sự tạo gỉ kim loại nêu trên. |
Lời giải:
Sắt bị gỉ trong không khí ẩm có là phản ứng oxi hóa – khử vì có sự trao đổi electron trong đó Fe là chất khử, O2 là chất oxi hóa.
3O2 + 4Fe + 6H2O → 4Fe(OH)3↓
Đề xuất một vài biện pháp hạn chế sự tạo gỉ kim loại nêu trên.
– Ngăn không cho kim loại tiếp xúc với môi trường: sơn mạ, bôi dầu mỡ … lên trên bề mặt kim loại.
– Chế tạo hợp kim ít bị ăn mòn: ví dụ như cho thêm vào thép một số kim loại như crom, niken để làm tăng độ bền.
CH tr 75 CH
| 8. Hãy viết các quá trình thay đổi số oxi hóa của mỗi nguyên tử nguyên tố trong phản ứng oxi hóa hoàn toàn methane. |
Lời giải:
CH4 + 2O2 → CO2 + 2H2O
C-4H4+ + O20 → C4+O22- + H2+O2-
Quá trình thay đổi số oxi hóa
C-4 → C4+ + 8e
O20 + 4e → 2O2-
Bài tập 1
|
Bài 1. Xác định số oxi hóa của mỗi nguyên tử trong các phân tử và ion sau đây: a) H2SO3 b) Al(OH)4– c) NaAlH4 d) NO2– |
Hướng dẫn giải:
– Cách xác định số oxi hóa
+ Quy tắc 1. Trong các hợp chất: Số oxi hóa của H là +1 (trừ NaH, CaH2, …); Số oxi hóa của O là -2 (trừ OF2, H2O2, …); Số oxi hóa của các kim loại kiềm (nhóm IA: Li, Na, K, ..,) là +1, kim loại kiềm thổ (nhóm IIA: Be, Mg, Ca, Ba, …) là +2, số oxi hóa của Al là +3.
+ Quy tắc 2. Tổng các số oxi hóa của các nguyên tử trong phân tử bằng 0, của một ion đa nguyên tử bằng chính điện tích của ion đó.
Lời giải:
a) H2SO3
Gọi x là số oxi hóa của S, theo quy tắc 1 và 2 có:
2.(+1) + 1.x + 3.(-2) = 0 → x = +4.
Vậy số oxi hóa của H là +1, của S là +4, của O là -2.
b) Al(OH)4–
Gọi x là số oxi hóa của Al, theo quy tắc 1 và 2 có:
1.x + 4.[1.(-2) + 1.(+1)] = -1 → x = +3.
Vậy số oxi hóa của Al là +3, của O là -2, của H là +1.
c) NaAlH4
Gọi x là số oxi hóa của H, theo quy tắc 1 và 2 có:
1.(+1) + 1.(+3) + 4.x = 0 → x = -1.
Vậy số oxi hóa của Na là +1, của Al là +3, của H là -1.
d) NO2–
Gọi x là số oxi hóa của N, theo quy tắc 1 và 2 có:
1x + 2.(-2) = -1 → x = +3.
Vậy số oxi hóa của N là +3, của O là -2
Bài tập 2
|
Bài 2. Xác định chất oxi hóa, chất khử, quá trình oxi hóa, quá trình khử trong các phản ứng sau: a) Ag+ + Fe2+ → Ag + Fe3+ b) 3Hg2+ + 2Fe → 3Hg + 2Fe3+ c) 2As + 3Cl2 → 2AsCl3 d) Al + 6H+ + 3NO3– → Al3+ + 3NO2 + 3H2O |
Hướng dẫn giải:
– Chất khử (chất bị oxi hóa) là chất nhường electron.
Na → Na+ + 1e (quá trình oxi hóa)
– Chất oxi hóa (chất bị khử) là chất nhận electron.
Cl + 1e → Cl– (quá trình khử)
Lời giải:
a) Ag+ + Fe2+ → Ag + Fe3+
Ag+ + 1e → Ag (quá trình khử)
Fe2+ → Fe3++ 1e (quá trình oxi hóa)
Chất oxi hóa: Ag+
Chất khử: Fe2+
b) 3Hg2+ + 2Fe → 3Hg + 2Fe3+
Hg2+ + 2e → Hg (quá trình khử)
Fe → Fe3+ + 3e (quá trình oxi hóa)
Chất oxi hóa: Hg2+
Chất khử: Fe
c) 2As + 3Cl2 → 2AsCl3
As → As3+ + 3e (quá trình oxi hóa)
Cl2 + 2e → 2Cl– (quá trình khử)
Chất khử: As
Chất oxi hóa: Cl2
d) Al + 6H+ + 3N5+O3– → Al3+ + 3N4+O2 + 3H2O
Al → Al3+ + 3e (quá trình oxi hóa)
N5+ + 1e → N4+ (quá trình khử)
Chất khử: Al
Chất oxi hóa: NO3–
Bài tập 3
|
Bài 3. Cân bằng các phản ứng oxi hóa – khử sau đây bằng Phương pháp giải thăng bằng electron a) NaBr + Cl2 → NaCl + Br2 b) Fe2O3 + CO → Fe + CO2 c) CO + I2O5 → CO2 + I2 d) Cr(OH)3 + Br2 + OH– → CrO42- + Br– + H2O e) H+ + MnO4– + HCOOH → Mn2+ + H2O + CO2 |
Hướng dẫn giải:
Bước 1. Xác định và ghi sự thay đổi số oxi hóa trước và sau phản ứng.
Al0 + O20 → Al23+O32-
Bước 2. Viết các quá trình oxi hóa và quá trình khử.
Al0 → Al3+ + 3e
O0 + 2e → O2-
Bước 3. Thăng bằng electron bằng cách nhân thêm hệ số vào các bán phản ứng nhường và nhận electron sao cho tổng số electron nhường bằng tổng số electron nhận. Cộng các bán phản ứng (đã nhân hệ số) với nhau sẽ thu được sơ đồ.
|
2 x 3 x |
Al0 → Al3+ + 3e O0 + 2e → O2- |
⇒ 2Al0 + 3O0 → 2Al3+ + 3O2-
Bước 4. Dựa vào sơ đồ để hoàn thành phương trình dạng phân tử.
4Al + 3O2 → 2Al2O3
Lời giải:
a) NaBr + Cl2 → NaCl + Br2
Na+Br– + Cl20 → Na+Cl– + Br20
|
1 x 1 x |
2Br– → Br20 + 2e Cl20 + 2e → 2Cl– |
⇒ 2Br– + Cl2→ Br2+ 2Cl–
2NaBr + Cl2 → 2NaCl + Br2
b) Fe2O3 + CO → Fe + CO2
Fe23+O2- + C2+O2- → Fe0 + C4+O22-
|
3 x 2 x |
C2+ → C4+ + 2e Fe3+ + 3e → Fe0 |
⇒ 2Fe3+ + 3C2+ → 2Fe + 3C4+
Fe2O3 + 3CO → 2Fe + 3CO2
c) CO + I2O5 → CO2 + I2
C2+O2- + I25+O52- → C4+O22- + I20
|
5 x 2 x |
C2+ → C4+ + 2e I25+ + 5e → I20 |
⇒ 5C2+ + 2I25+ → 5C4+ + 2I2
5CO + 2I2O5 → 5CO2 + 2I2
d) Cr(OH)3 + Br2 + OH– → CrO42- + Br– + H2O
Cr3+(OH)3– + Br20 + OH– → Cr6+O42- + Br– + H2O
|
2 x 3 x |
Cr3+ → Cr6+ + 3e Br20 + 2e → 2Br– |
⇒ 2Cr3+ + 3Br20 → 2Cr6+ + 6Br–
2Cr(OH)3 + 3Br2 + 10OH– → 2CrO42- + 6Br– + 8H2O
e) H+ + MnO4– + HCOOH → Mn2+ + H2O + CO2
H+ + Mn7+O4– + H1+C2+O2-O2-H1+ → Mn2+ + H2O + C4+O2
|
5 x 2 x |
C2+ → C4++ 2e Mn7+ + 5e → Mn2+ |
⇒ 2Mn7+ + 5C2+ → 2Mn2++5C4+
6H+ + 2MnO4– + 5HCOOH → 2Mn2+ + 8H2O + 5CO2
Bài tập 4
|
Bài 4. Nước oxy già có tính oxi hóa mạnh, do khả năng oxi hóa của hydrogen peroxide (H2O2). a) Từ công thức cấu tạo H – O – O – H, hãy xác định số oxi hóa của mỗi nguyên tử. b) Nguyên tử nguyên tố nào gây nên tính oxi hóa của H2O2. Viết các quá trình oxi hóa, quá trình khử minh họa. |
Hướng dẫn giải:
– Dựa theo công thức cấu tạo.
+ Cách tính điện tích các nguyên tử trong hợp chất với giả định đó là hợp chất ion dựa vào công thức cấu tạo.
Lời giải:
a) H – O – O – H
Số oxi hóa của H là +1
Gọi x là số oxi hóa của O, theo quy tắc 1 và 2 có:
1.(+1) + 1.x + 1.x + 1.(+1) = 0 → x = -1.
Vậy số oxi hóa của H là +1, của O là -1 (trường hợp đặc biệt).
b) Nguyên tố O gây nên tính oxi hóa của H2O2.
2Fe2+ + H2O2 + 2H+ → 2Fe3+ + 2H2O(quá trình oxi hóa)
2Fe3+ + H2O2 + 2OH- → 2Fe2+ + 2H2O + O2 (quá trình khử)
Bài tập 5
|
Bài 5. Xăng E5 là một loại xăng sinh học, được tạo thành khi trộn 5 thể tích ethanol C2H5OH (cồn) với 95 thể tích xăng truyền thống, giúp thay thế một phần nhiên liệu hóa thạch, phù hợp với xu thế phát triển chung trên thế giới và góp phần đảm bảo an ninh năng lượng quốc gia. Viết phương trình đốt cháy ethanol thành CO2 và H2O. Phản ứng này có phải là phản ứng oxi hóa – khử hay không? Nó thuộc loại phản ứng cung cấp hay tích trữ năng lượng? |
Lời giải:
C2H5OH + 4O2 → 3CO2 + 3H2O
C22-H5+O2-H+ + O20 → C4+O22- + H2O
C2- → C4+ + 6e (quá trình oxi hóa)
O20 + 4e → 2O2- (quá trình khử)
Phản ứng này có là phản ứng oxi hóa – khử. Nó thuộc loại phản ứng cung cấp năng lượng.
Lý thuyết
>> Xem chi tiết: Lý thuyết bài 13: Phản ứng oxi hóa – khử
Hy vọng với nội dung trong bài Giải hóa 10 bài 13 trang 70, 71, 72, 73, 74, 75, 76 Cánh diều
do thầy cô trường Trung học Bình Chánh biên soạn sẽ giúp các em nắm chắc kiến thức nội dung bài học tốt hơn để từ đó hoàn thành tất cả các bài tập trong SGK.
Đăng bởi: THCS Bình Chánh
Chuyên mục: Hóa học 10 Cánh Diều
- Giải Hóa 10 Bài 1 trang 6, 7, 8, 9, 10 Cánh diều
- Giải Hóa 10 Bài 2 trang 11, 12, 13, 14, 15 Cánh diều
- Giải Hóa 10 Bài 3 trang 16, 17, 18, 19, 20 Cánh diều
- Giải Hóa 10 Bài 4 trang 21, 22, 23, 24, 25 Cánh diều
- Giải Hóa 10 Bài 5 trang 26, 27, 28, 29, 30 Cánh diều
- Giải Hóa 10 Bài 6 trang 31, 32, 33, 34, 35, 36, 37 Cánh diều